Новые методы иммунодиагностики и критерии их оценки
ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ
Основной отличительной чертой иммуноферментного анализа (ИФА) является то, что ; в качестве индикаторной молекулы, которая позволяет следить за иммунным комплексом, используется молекула фермента. В связи с тем что фермент обладает уникальным свойством модифицировать не одну, как в обычных химических реакциях, а большое число молекул субстрата, т. е. обладает своего рода усиливающим свойством, чувствительность иммуноферментных методик может быть очень высока. В некоторых случаях, как показывают многочисленные сравнительные исследования, она выше чувствительности иммунофлуоресцентных и радиоиммунологических методов.
История создания иммуноферментных методик начинается с момента, когда биохимики начали ковалентно иммобилизовывать («пришивать») молекулы ферментов к молекулам белков и, в частности, к молекулам иммуноглобулинов. Однако потребовалось пять лет для создания методики иммуноферментного анализа именно в том виде, в каком мы используем его в настоящее время. Принципы этого метода следующие:
- комплекс антиген - антитело можно выявить, если ввести в состав одного из участников иммунной реакции (ковалентно «пришить») одну или несколько молекул фермента. Причем эта процедура на промежуточных (в процессе «пришивки») и финальной стадии (конъюгат антигена или антитела с ферментом) не должна изменять иммунные (свойства фермент-меченного участника иммунной реакции;
удобно выявлять иммунный комплекс, используя способность фермента расщеплять субстрат, который при ферментативной модификации изменяет свой цвет. В этом случае для выявления комплекса антиген - антитело обычно используют спектрофотометрию;
- ммунный комплекс можно выявлять с помощью иммуноферментного анализа как в растворе, так и при адсорбции (или ковалентной иммобилизации) на твердом носителе. Различают два принципиально различных типа ИФА - гомогенный и гетерогенный (твердофазный) иммуноферментный анализ.
Гомогенный иммуноферментный анализ (ГИФА) - наиболее простой в методическом отношении вид ИФА. При его постановке один из участников иммунной реакции (обычно это низкомолекулярный антиген) метится ферментом и за ходом формирования комплекса антиген-антитело следят, регистрируя изменение активности фермента.
Такое нарушение ферментативной активности может возникать либо за счет пространственного разобщения фермента и субстрата, либо за счет конформационных изменений в молекуле фермента, сопровождающих формирование иммунного комплекса. ГИФА имеет ряд существенных преимуществ перед другими иммунохимическими методами. Во-первых, высокая экспрессия (весь анализ с помощью ГИФА , занимает минуты и даже доли минут).
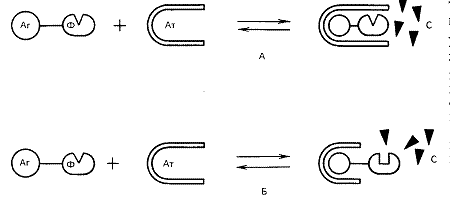
Рис. Варианты гомогенного иммуноферментного анализа (А- эффект разобщения фермента (Ф) и субстрата (С) за счет стерических препятствий при взаимодействии антигена (Аг) и антитела (Ат); Б- эффект изменения конформации фермента при формировании комплекса антиген- антитело.
Во-вторых, метод имеет одну стадию и не требует трудоемких и требующих времени этапов промывки. И наконец, в-третьих, метод требует минимальных объемов (8-50 мкл) и количеств биологического или клинического образца. Однако у метода ГИФА имеется один крайне существенный недостаток - на его основе можно создавать диагностические тест-системы только для низкомолекулярных антигенов. Только, в этом случае антитело, взаимодействуя с антигеном, может эффективно экранировать или модифицировать связанную с этим антигеном молекулу фермента. Именно в связи с этим, ( несмотря на кажущуюся простоту и очевидные преимущества перед другими методами, на основе ГИФА были созданы диагностикумы для выявления только гормонов, пептидов, лекарственных и наркотических веществ и некоторых низкомолекулярных белков.
Гетерогенный (твердофазный) иммуноферментный анализ (ТФИФА или ЕLISА) в последние годы особенно широко используется в биологии и медицине. Как и для других твердофазных методов анализа, характерной особенностью ТФИФА является то, что в процессе проведения анализа один из участников реакции антиген - антитело иммобилизуется на твердом носителе. Эту фиксацию антигена или антител можно осуществлять либо путем их ковалентной «пришивки» к полимерной или стеклянной матрице, либо путем их физической адсорбции на твердом носителе за счет достаточно прочных сил электростатического и ван-дер-ваальсового взаимодействия. Идея иммобилизации иммунного комплекса важна для анализа многокомпонентных смесей макромолекул, когда в системе должны оставаться только те компоненты смеси, которые обладают нужными иммунохимическими свойствами. Именно твердофазные методики позволяют избавиться от балластных, не вошедших в иммунный комплекс антигенов простой промывкой.
Необходимо отметить, что в своей физико-химической основе твердофазный ИФА очень сходен с твердофазным РИА. Отличие касается лишь индикаторных молекул - в ТФИФА это фермент, в твердофазном РИА это радиоактивные изотопы. Остальные же принципы анализа полностью совпадают - в обоих методах используется твердая матрица, на которой адсорбируется иммунный комплекс, и идентичный способ удаления из системы не вошедших в комплекс компонентов диагностикума.
В настоящее время уже опубликованы обзоры, подробно анализирующие схемы проведения диагностических исследований с использованием метода твердофазного ИФА.
Для обнаружения в биологических и клинических образцах бактериальных и вирусных антигенов особенно часто применяется так называемый сэндвич-метод или модифицированный сэндвич-метод. При использовании этих методик на твердую подложку (обычно полистирол) сорбируются последовательно первичные антитела, выявляемый антиген и вторичные антитела. В случае двойного сэндвич-метода ферментная метка вводится в состав вторичных антител, в случае модифицированного двойного сэндвич-метода вторичные антитела (немеченые) «проявляются» антивидовыми меченными ферментом иммуноглобулинами. Особая популярность последней разновидности ТФИФА объясняется тем, что для выполнения методики нет необходимости синтезировать специфические для каждого конкретного антигена конъюгаты (меченные ферментом антитела).
В последние годы были разработаны методики ТФИФА, использующие в качестве «проявляющих» конъюгатов молекулярные комплексы ферментов с белком А золотистого стафилококка. Как известно, это белок взаимодействует с высокой константой связывания с тяжелой цепью (Fс-фрагментами) иммуноглобулинов. Это позволяет построить диагностические системы, где - в качестве «проявляющего» агента используются не антивидовые антитела, а белок А. В этом случае, однако, возникают некоторые трудности, связанные с неспецифичностью белка А, который взаимодействует с Fс-фрагментами любых антител. Если использовать обычную сэндвич-методику, заменив лишь антивидовой конъюгат на конъюгат на основе белка А, последний будет взаимодействовать не только со вторичными антителами, но и с первичными иммуноглобулинами, давая положительную реакцию, даже если проба не содержит искомого антигена. В этом случае имеется несколько вариантов решения проблемы. Во-первых, в качестве первичных антител в методике можно использовать иммуноглобулины, с которыми белок А взаимодействует слабо (например, с мышиными иммуноглобулинами). Во-вторых, возможна прямая адсорбция антигена на полистирол, когда первичные антитела просто не используются. И, наконец, в качестве первичных антител можно применять не полные молекулы иммуноглобулинов, а молекулы, лишенные Fс-фрагментов, - так называемые Раb2 -фрагменты. В этом последнем случае дополнительным удобством методики будет являться то, что для конструирования диагностической системы можно будет использовать не две сыворотки, полученные от разных животных, а одну. Именно в связи с этими обстоятельствами в настоящее время разработано и разрабатывается большое число диагностических методик, использующих конъюгаты на основе белка А.
