Алкилирование енаминов, бета-дикетонов и енаминокетонов
Енамин-иминная таутомерия может обуславливать быструю рацемизацию некоторых веществ в протонных растворителях, препятствуя тем самым разделению энантиомеров соединений, содержащих в углеродном скелете группировку
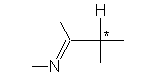
Авторы [8] наблюдали рацемизацию (S)-тетрагидрозолина, обусловленную таутомерными переходами:
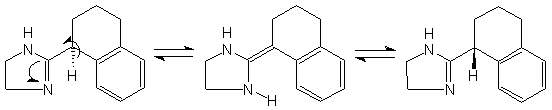
Исследование кинетики реакции рацемизации показало, что содержащие протон асимметрические центры по соседству с иминной группой “долго не живут”.
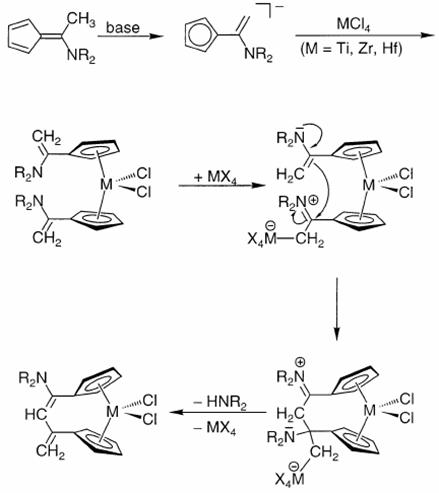
Реакции ароматических енаминов могут катализироваться тетрагалогенидами Ti, Zr, Hf [9]. В качестве любопытного примера реакции алкилирования енамина можно привести осуществленную совсем недавно межлигандную конденсацию [10]:
β-енаминокетоны.
Один из наиболее удобных синтетических методов получения сложных енаминонов, в том числе оптически активных – синтез на основе природных терпеноидов – лимонена, 3-карена и δ-кадинола. Эти соединения, интересные сами по себе (отмечена их биологическая активность), являются ключевыми промежуточными продуктами в асимметрическом синтезе [11]. Енаминокетоны, полученные из этих терпенов, используются как хиральные основания для разделения энантиомеров оптически активных кислот [12].
Енаминная система в щелочных средах может быть депротонирована и продукт введен в реакцию с алкилирующими агентами.
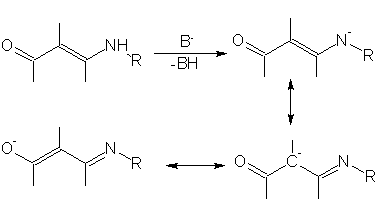
До последнего времени считалось, что преобладающими продуктами реакций алкилирования енаминокетонов являются N-замещенные производные [13]. Данные последующих исследований показывают, что алкилирование некоторых β-енаминокетонных систем в условиях межфазного переноса может быть селективно проведено и по атому углерода [14]:
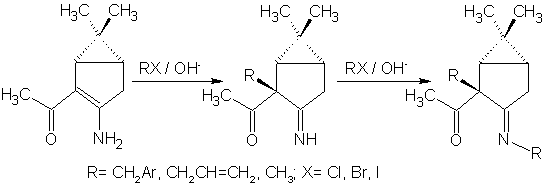
Приведенная последовательность превращений характерна, однако, только для алкилирования стерически нагруженными алкилгалогенидами. При использовании в качестве галогенида йодистого метила образуются все продукты вплоть до пентазамещенного. Исходя из данных настоящей работы, можно отметить, что направление алкилирования приведенных на рисунке соединений существенно зависит также от температуры реакции: при 35°С преобладает продукт С-алкилирования, при более низких температурах из смеси удается выделить N-алкилзамещенный продукт, доля С-замещения при этом невелика.
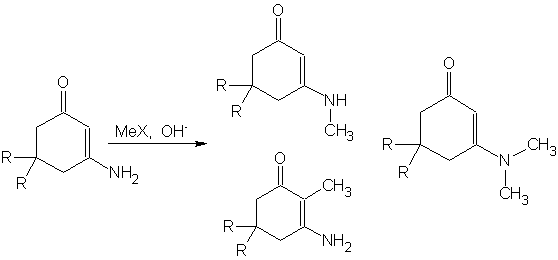
В работе [13] исследовано алкилирование 3-амино-5,5-диалкилциклогекс-2-ен-1-она для различных алкильных заместителей и проведен анализ факторов, необходимых для селективного направления алкилирования по тем или иным положениям изученного енаминона:
 Зависимость хода реакции алкилирования аналогичного [13] циклического енаминокетона от природы боковых радикалов изучена авторами [3]:
Зависимость хода реакции алкилирования аналогичного [13] циклического енаминокетона от природы боковых радикалов изучена авторами [3]:

Среди известных реакций енаминонов внимания также заслуживает описанная в [15] реакция фотоарилирования:
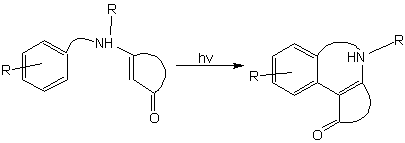
Авторы утверждают, что облучение енаминонов светом с длиной волны < 300 нм “can result in the formation of a variety of products… …photoreductions predominate”.
Из приведенных литературных данных можно сделать выводы об условиях, необходимых для получения высоких выходов С-алкилированных производных енаминов, b-дикетонов и енаминонов:
1. Необходим подбор основности среды. В низкоосновных средах мала концентрация активного аниона и реакция протекает медленно, в слишком высокоосновной среде происходит депротонирование атома азота и преобладающим становится продукт N-алкилирования.
2. Упомянутые выше требования к кинетике процесса алкилирования должны быть удовлетворены в максимальной степени.
3. С-алкилированный продукт, получающийся при повышенных температурах, является следствием термодинамического контроля реакции реакции алкилирования, при снижении температуры реакции возрастает доля продуктов кинетического контроля -- N- и O-алкилированных продуктов.
4. Асимметрическая индукция от имеющихся структурных фрагментов может обеспечивать отмеченное многими авторами стереоселективное протекание реакции алкилирования [2, 3, 5, 11, 12, 14].
В целом можно отметить, что несмотря на широкую известность описанных соединений, реакции алкилирования с их участием изучены пока недостаточно.
![]()
Экспериментальная часть.
Синтез (3-амино-6,6-диметилбицикло[3.1.0]гекс-2-ен-2-ил)метилкетона II:
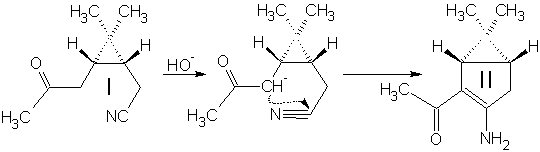
К 350 мл спиртового раствора KOH при перемешивании в течение 10 мин. добавили 100 г кетонитрила I. Смесь нагрели и кипятили с обратным холодильником 15 мин., охладили и разбавили водой в три раза. Провели экстракцию смеси метилтретбутиловым эфиром (300, 300, 150 мл), эфирную фазу экстрагировали 1М HCl (900, 500, 300 мл). Полученный водный раствор нейтрализовали 30% аммиаком и экстрагировали tBuOMe (200, 200, 100 мл). Эфирный раствор высушили MgSO4 безв и отогнали растворитель. Выход 79%.
Синтез (3-амино-2-бензил-6,6-диметилбицикло[3.1.0]гекс-2-ил)метилкетона III:
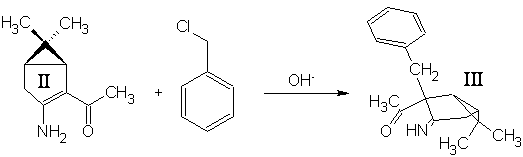
5 г енаминокетона IIрастворили в 30 мл бензола, в раствор добавили 15 мл 40% водного раствора NaOH и 0.5 г Bu4N+NO-3, перемешивали несколько минут и постепенно (3 мин.) добавили 10 мл бензилхлорида. Смесь интенсивно перемешивали 1.5 часа при 35-40˚С. Водную фазу отбросили, органическую экстрагировали 1М H2SO4 (15, 15, 15 мл). Экстракт нейтрализовали избытком 30% аммиака и экстрагировали метилтретбутиловым эфиром. Эфирный раствор высушили MgSO4 безв и отогнали растворитель. Выход 44%.
Синтез 1-(3-амино-6,6-диметилбицикло[3.1.0]гекс-2-ен-2-ил)этанола:
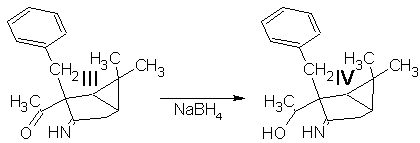
4 г алкилированого енаминокетона IIIрастворили в 40 мл этанола. В раствор всыпали 0.6 г NaBH4 и перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь разбавили водой и экстрагировали эфиром. Эфирную фазу промыли водой для удаления спирта и вылили в водный раствор 4 г Cu(OAc)2·2H2O. Голубые кристаллы отфильтровали и высушили на воздухе.
Продукты исследовали методами хроматомасс-спектрометрии, ИК и ЯМР 13C и 1H. ЯМР спектры регистрировали на приборе Bruker DPX-500 (НИОХ СО РАН) в смеси CCl4/CDCl3; химсдвиги отсчитывали: в протонных спектрах – от сигнала остаточных протонов CDCl3 (7.250 м.д.), в спектрах 13С – от сигнала атома углерода CCl4 (96.10 м.д.). ИК спектры записывали на однолучевом спектрометре Bruker Vector 22 (256 усреднений с вычетом фона). Хроматомасс-спектрометрический анализ выполнен сотрудниками НИОХ.
