Аналитическая химия
- Метрологические хар-ки анализа. Погрешность. Воспроизводимость. Для оценки выбранного метода проводят многократные анализы стандартов, различия между данными и истинным составами служит мерой надежности проверяемого метода. Результаты эксперимента обрабатывают методами математ. статитстики. К метрологическим хар-кам относят: погрешность хим. анализа. Погрешность выражает собой правильность результатов. По способу вычисления погрешности делят на абсолютную (хi -μ= разность между полученным и истинным значением определяемой величины, выраж. в ед-цах опред-ой велич.) и относительную (=отношение абсолютной погрешности к истинному значению определяемой величины: (хi-μ)/μ – не имеет размерности, выраж-ся в %). Воспроизводимость – согласование нескольких результатов между собой, т.е. степень близости друг к другу единичных определений; выраж-ся отклонением эксперимент. данных от их среднеарифметич. значении и хар-ет возможность повторного получения аналогичных рез-тов. Определение воспроизв. нужно для сравнения методик анализа, контроля работы аналитика, выяснения возможности использования отличающегося от др. рез-та при мат. обработке, расчета среднего арифм. х. Мера воспроизв: отклонение, стандартное отклонение, диапазон значений.
- Правильность. Предел обнаружения. Ошибка и отклонение. Систематические и случайные ошибки. Абсолютная и относительная ошибка. Правильность – близость рез-та хi или среднего арифмет. нескольких рез-тов к истинному значению μ – качество хим. анализа, отражающая близость к 0 систематической погрешности. Ошибка – отклонение полученных значений от теоретического. Отклонение – мера воспроизводимости. Систематические ошибки - направленное отклонение полученных рез-тов от теор-ого; имеет одтн и тот же знак, на рез-ты оказывает одно и то же влияние. Виды сист. ошибок: 1) аддитивные: при неучете расхода реагента на холост. пробу; 2) мультипликативные: неверный титр или грудуировка прибора; 3) нелинейно связанные: проявл-ся многообразно, причина выясн. в каждом конкретном случае. Случайные ошибки нельзя устранить, так как в каждои физ. измерении допуск. неточность. По способу вычисления ошибки делят на абсолютные (хi -μ= разность между полученным и истинным значением определяемой величины, выраж. в ед-цах опред-ой велич.) и относительные (=отношение абсолютной ошибки к истинному значению определяемой величины: (хi-μ)/μ – не имеет размерности, выраж-ся в %).
- Абсолютное и относительное отклонения. Среднее отклонение. Стандартное отклонение. Среднее отклонение (d) – среднее арифметическое модуля отдельных отклонений от средней величины: đ=1/nΣ|хi –х|. Стандартное отклонение (S) – корень среднего значение квадратов отдельного отклонения от среднего: S=
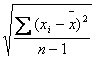 . Относительное отклонение (которым могут быть выражены среднее и стандартное): Sr=S/x∙100
. Относительное отклонение (которым могут быть выражены среднее и стандартное): Sr=S/x∙100 - Значащие цифры – все достоверно известные цифры данного числа + первая недостоверная цифра. Нули, стоящие между др. цифрами – значащие, в начале числа – нет, в конце – да. Рез-т вычисление должен содержать только знач. числа.
- Правильность анализа и доверительные границы. Правильность – близость рез-та хi или среднего арифмет. нескольких рез-тов к истинному значению μ – качество хим. анализа, отражающая близость к 0 систематической погрешности. Границы истинного значения – пределы, в кот. заключено истинное значение измеряемой велич, т. е. х-εα < μ<εα+x, где εα – доверительные границы – пределы, предсказанные д/определенной верности α. Нахождением границ истинного значения ограничиваются, когда число измерений невелико, >30. Верность предсказания не может составлять 100%, всегда допускается доля риска α или доверительная вероятность 100-100α. Доверит. вероятность α показывает верность попадания случайного знач-ния в заданный интервал. Доверительные границы: х±
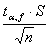 , где tα, fа – коэф. нормированных отклонений, f – число нормированных отклонений (число независ. способов, кот. можно изменить сос-ния системы при изменении пар-ров сос-ния): f=n-1.
, где tα, fа – коэф. нормированных отклонений, f – число нормированных отклонений (число независ. способов, кот. можно изменить сос-ния системы при изменении пар-ров сос-ния): f=n-1. - Характерные р-ции катионов и анионов. Катионы: 1) белый осадок при действии 2н HCl на Ag2+, Pb2+; 2) белый осадок при действии 2н Н2SO4 на Pb2+, Ba2+; 3) H2SO4+Pb2+, Ba2+, Ca2+ à белый осадок; 3) NaOH+Mg2+; Ca2+, катионы III & IV гр à образов. осадка; 4) NaOH (изб)+Al3+, Zn2+, Cr3+, Pb2+ à раствор. осадка гидрокс. 5) NH4OH до щелочн. сред + Hg2, катионы III, IV гр. à цвет осадка 6) NH4OH изб. + Zn2+, Ag2+, Cu2+ à раствр. осадка гидрокс. Окрас горелки пламени: Sr2+ à карминово-красн; Са2+ à кирпично-красн; Na+à желтый; Ва2+ à желто-зелен; Сu2+, Bi3+ à зеленый; As, Sb, Pb2+à светло-голубой; Rb+, Cs+àярко-голуб; К+ à фиолет. Анионы: растворимs в Н2О: Cl-, Br-, I-, SO4-, NO3-, растворимы в HCl: CO3-, SO4-, SO3-, PO32-, оксиды, гирокс.
- Особенности аналитич. ре-ций и способы их выполнения. Аналит. р-ции позволяют обнаруживать эл-ты в сос-ве анализ. вещ-ва в форме катионов и анионов, используя при этом: 1) образов. характ. ярко окрашенных соедин; 2) изменение окраски при соед. анализ. образца с опред-ными реаг-ми; 3) выпадение осадка, выделение газа; 4) получение кристаллов опред. формы; 5) характерн. окрашив. пламени горелки парами вещ-ва; 6) получение окрашенных перлов. При исп.в качеств анализе ионных реа-ций в рас-рах (аналит. реакций), последние должны быть: а) иметь легко наблюдаемый внешний эффект: изменение окраски, образов осадка, растворение осадка, выделение газа б) протекать быстро в) быть практич. необратимыми г) обладать дотаточной чувств.
- Характеристика аналитических реакций, чувствительность, селективность. Чувствит. АР хар-ся открываемым минимумом (наименьная масса вещ-ва, способная быть открытой с помощью данного реактива, мкг), min (lim) концентр (показывает, при какой мин. конц вещ-ва в раст-ре с помощью данной р-ии можно открыть определ. вещ-во ), предельным разбавлением (наим. концентрация открываемого иона в р-ре, при кот. извест V р-ра ещё даеь положит реак-цию). Чем < открыв. min, min конц и чем > предел разбавл, тем чувствит. реакция. Чувст-ть зависит от усл протекания, t0, конц реаг-та, времени наблюд от начала опыта, присутсв посторонних вещ-в, кислотности. Селектиыность р-ции – возможность применения р-ции к небольшому числу ионов.
- Групповой реагент и условие его применения. Гр реаг-т – реактив, дающий общие реак-ции и служащий д/отделения одной ан.гр от другой. Они должны удовлетв след. треб: 1) практически осаждать все ионы данной ан. гр; 2) полученный осадок должен легко рас-ся в кислотах д/продолжения анализ; 3) избыток добавляемого реагента не должен мешать дальнейшему ходу анализа. Групповые реагенты использ. в систематическом химич. анализе.
- Методы качесвтенного ан-за. Систем. и дробный ан-з. Методы кач-ого хим. ан: -сероводородный (основан на образ. нераствор. сульфидов, в кач-ве реагента исп-ся Н2S или MexSy), - бессероводородный (напр.: аммиачно-фосфатный, основан на исп-нии различной раст-ти фосфатов в Н2О, кислотах, ще и водном р-ре NH3) – кислотно-основной (катионы различ. по отнош их к мин. солям и Ще) – макро (1-10г), микро (10-3-10-4г), микрометоды (0,05-0,5 г) – капельный метод (взаимодействие капель анализ р-ра и капли р-та на платинке) – микрокристаллоскопический (наблюдение под микроскопом характ формы, цвета и размеров кри-ов химич. индивид. вещ-ва). Дробный ан – позволяет с помощью характ. р-ции обнаруживать к-либо ион в присутствии других ионов. Систематический хим ан – сос-ит в последовательном разделении сложной смеси ионов на отдельные группы, осаждаемые определенным групповым реагентом.
- Аналитическая классификация катионов:
| Ан. гр. | Катионы | Групповой реагент | Формула осаждаем. соед. |
| I | Na+, K+, Mg2+ | --- | |
| II | Ca2+, Sr2+, Ba2+ | (NH4)2CO3 | MeCO3 |
| III | Al3+, Fe2+, Cr3+, Fe3+, Mn2+, Co2+, Ti2+, Zn2+ | (NH4)2S | MeS, Me(OH)3 |
| IV | Cu2+, Cd2+, Hg2+, Bi3+, As (III), As (V), Sb (III, V), Sn (II, IV) | H2S, HCl | MenSm |
| V | Ag+, Pb2+, Hg2+2 | HCl | MeCln |
