Топливные элементыРефераты >> Технология >> Топливные элементы
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1. ПРИНЦИП ДЕЙСТВИЯ ТОПЛИВНЫХ ЭЛЕМЕНТОВ
2. ОСНОВНЫЕ ПРОБЛЕМЫ ТЭ
3. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
4. ОСНОВНЫЕ ТИПЫ ТЭ И ЭНЕРГОУСТАНОВОК
СПИСОК ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
К наиболее серьезным проблемам, стоящим перед человечеством, безусловно, относится экологическая проблема. Наряду с локальными экологическими бедствиями такими, как смог в крупных городах, высокий уровень вредных выбросов на отдельных предприятиях, прорывы нефтепроводов и аварии нефтеналивных танкеров, возникли общепланетарные явления, такие, как парниковый эффект, озоновые дыры и кислотные дожди [1]. Наиболее крупный вклад в загрязнение окружающей среды вносят энергетика и транспорт (рис. 1). Основные выбросы вредных компонентов возникают в результате химических процессов горения топлива в парогенераторах и двигателях внутреннего сгорания. Следует также отметить, что процессы преобразования химической энергии в электрическую характеризуются невысокими значениями КПД (20-40%).
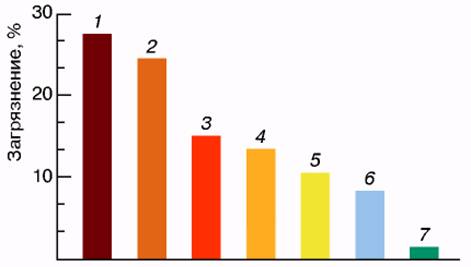
Рис. 1. Доли загрязнений атмосферы различными отраслями техники в России: 1 - теплоэнергетика, 2 - черная металлургия, 3 - нефтедобыча и нефтепереработка, 4 - автотранспорт, 5 - цветная металлургия, 6 - промышленность стройматериалов, 7 - химическая промышленность.
Вместе с тем известны способы преобразования энергии, например электрохимический, практически лишенные указанных недостатков. Электрохимический способ преобразования энергии осуществляется в топливных элементах (ТЭ) [2, 3].
1. ПРИНЦИП ДЕЙСТВИЯ ТОПЛИВНЫХ ЭЛЕМЕНТОВ
В топливных элементах химическая энергия топлива и окислителя, непрерывно подводимых к электродам, превращается непосредственно в электрическую энергию, в то время как в тепловых машинах процесс преобразования химической энергии протекает через несколько промежуточных стадий, в том числе через стадию образования теплоты (рис. 2). Выбор топлива и окислителя, подаваемых в ТЭ, определяется в первую очередь их электрохимической активностью (то есть скоростью реакций на электродах), стоимостью, возможностью легкого подвода реагента в ТЭ и отвода продуктов реакции из ТЭ. В качестве топлива в ТЭ обычно используется водород, реже СО или СН4, окислителем обычно является кислород воздуха. Рассмотрим для примера работу кислородно-водородного ТЭ с щелочным электролитом (раствором КОН).
Реакция окисления водорода
2Н2 + О2 = 2Н2О (1)
в ТЭ протекает через электроокисление водорода на аноде
2Н2 + 4ОН - 4е → 4Н2О (2)
и электровосстановление кислорода на катоде
О2 + 2Н2О + 4е → 4OH- (3)
Гидроксид-ионы двигаются в ионном проводнике (электролите) от катода к аноду, а электроны во внешней цепи – от анода к катоду. Суммируя уравнения реакций (2) и (3) получим уравнение реакции (1). Таким образом, в результате реакции (1) во внешней цепи протекает постоянный электрический ток, то есть происходит прямое преобразование химической энергии реакции (1) в электрическую.
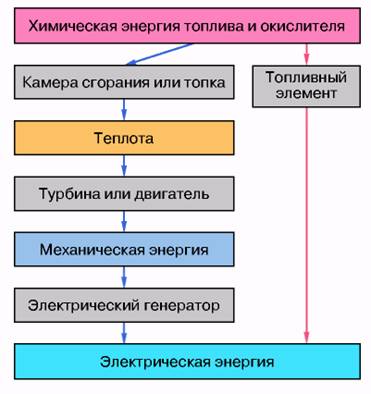
Рис. 2. Ступени преобразования химической энергии традиционным и электрохимическим способами
Электродвижущую силу (ЭДС) ТЭ можно рассчитать по уравнениям химической термодинамики
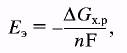 (4)
(4)
где Eэ – ЭДС, DGх.р – изменение энергии Гиббса в результате протекания химической реакции, n – число электронов на молекулу реагента, F – постоянная Фарадея (96484 Кл/моль). Например, расчет по уравнению (4) для реакции (1) и воды в жидком состоянии при давлениях О2 и Н2, равных 100 кПа, дает значение Еэ 298 = 1,23 В.
Так как процесс преобразования энергии не имеет промежуточной стадии генерации теплоты (см. рис. 2), то для электрохимического способа нет ограничения цикла Карно и теоретический КПД преобразования энергии можно рассчитать по уравнению
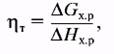 (5)
(5)
где DHх.р – изменение энтальпии в результате протекания химической реакции (тепловой эффект реакции). Например, КПД, рассчитанный по уравнению (5), равен ηт,298 – 1,0 для метана и ηт,298 = 0,94 для водорода.
Принципиальная схема ТЭ представлена на рис. 3. Топливные элементы, как и другие источники тока (гальванические элементы и аккумуляторы), состоят из анода, катода и ионного проводника (электролита) между ними. Основное отличие ТЭ от гальванических элементов заключается в том, что в ТЭ используются нерасходуемые электроды, поэтому ТЭ могут работать длительное время (до нескольких десятков тысяч часов). Реагенты в ТЭ поступают во время работы, а не закладываются заранее, как в гальванических элементах и аккумуляторах. В отличие от аккумуляторов ТЭ не требуют подзарядки. Реальный ТЭ имеет сложное строение по сравнению со схемой, представленной на рис. 3.
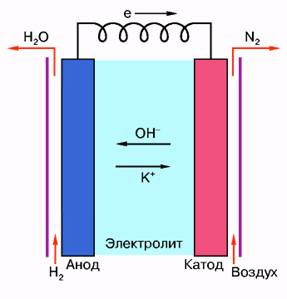
Рис. 3. Принципиальная схема ТЭ
Впервые о ТЭ в 1839 году сообщил английский исследователь Гроув, который при проведении электролиза воды обнаружил, что после отключения внешнего тока в ячейке генерируется постоянный ток. Однако работа Гроува тогда не могла быть реализована. Не удалось реализовать и идею известного физикохимика В. Оствальда (1894 год) о генерации электрической энергии в ТЭ, работающих на природных углях, а также изобретенного русским ученым П. Яблочковым (1887 год) водородно-кислородного ТЭ и результатов других исследований и изобретений. Интерес к ТЭ снова возродился в начале 50-х годов после публикации в 1947 году монографии российского ученого О. Давтяна, посвященной ТЭ [4]. Работы по ТЭ ведутся в США, Японии, Германии, России, Италии, Канаде, Голландии и других странах. Первое практическое применение ТЭ нашли на космических кораблях "Джемини", "Аполлон" и "Шаттл". В России была созданы ТЭ для корабля "Буран" [5]. Интерес к ТЭ снова повысился с конца 70-х – начала 80-х годов в связи с необходимостью разработки экологически чистых стационарных и транспортных энергоустановок.
2. ОСНОВНЫЕ ПРОБЛЕМЫ ТЭ
Как и любой источник тока, ТЭ характеризуются напряжением, мощностью и сроком службы. Напряжение U топливного элемента ниже ЭДС из-за омического сопротивления электролита и электродов R и поляризации катода DЕК и анода DЕа,
U = Еэ – IR – (DЕК + DЕа), (6)
где / – сила тока.
Поляризация электродов обусловлена замедленностью процессов, протекающих на электродах, и равна разности потенциалов электрода под током ЕI и при отсутствии тока ЕI=0
DЕ = ЕI – ЕI=0
Поляризация электродов возрастает с увеличением плотности тока /, то есть тока, отнесенного к единице площади поверхности электрода S:
