Валентность и степень окисления
ПЛАН.
· Развитие истории химии………………………… стр.3
· Первые электронные теории ковалентности и гетеровалентности. ………………………………. стр.4
· ВАЛЕНТНОСТЬ в комплексных соединениях. ………………………………………………………… стр. 7
· Термин «Валентность»…………………………………… ….стр.11
· Связь понятия «валентность» с другими химическими терминами. Степень окисления.………………………………………….стр.11
· Современные квантово-химические представления о валентности ………………………………………………………… стр.13
· Список используемой литературы. ………………………………………………………… стр.17
Развитие истории химии. В начале 19 века Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в окислах азота -N2O, NO, N2O3, NO2 и N2O5). В середине 19 в, когда были определены точные относительные веса атомов (И. Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Например, атом F может соединяться лишь с одним атомом Н, О - с двумя, N - с тремя, С - с четырьмя, образуя соответственно HF, H2O, NH3 и CH4. Два или четыре атома Н в метане CH4 могут быть замещены одним или двумя атомами О с образованием формальдегида CH2O и двуокиси углерода CO2 соответственно, три атома Н в CH4 могут замещаться одним атомом N с образованием цианистого водорода HCN, и т.д. Эта способность связывать или замещать определённое число других атомов и была названа "ВАЛЕНТНОСТЬ." (Э. Франкленд, 1853). В таком определении ВАЛЕНТНОСТЬ, естественно, всегда выражается целыми числами. Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом Н был выбран в качестве стандарта, обладающего ВАЛЕНТНОСТЬЮ, равной 1. В "водородной" шкале кислород и сера имеют ВАЛЕНТНОСТЬ, равную 2, азот и фосфор 3, углерод и кремний 4. Однако "водородной" шкалы оказалось недостаточно: в других соединениях, например в окислах, один и тот же элемент может реализовать ВАЛЕНТНОСТЬ, которые не осуществляются в гидридах (существуют окислы P2O5, SO3 и Cl2O7, но неизвестны гидриды PH5, SH6 и ClH7). В качестве второго стандарта с ВАЛЕНТНОСТЬЮ, равной 2, был выбран кислород. В конце 50-х гг. 19 А. С. Купер и А. Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о ВАЛЕНТНОСТИ составили важную часть теории химического строения А. М. Бутлерова (1861) Образование химической связи рассматривалось как результат взаимного насыщения двух пар взаимодействующих атомов (по одной ВАЛЕНТНОСТИ от каждого), кратные связи соответствовали насыщению нескольких ВАЛЕНТНОСТЕЙ от каждого атома, и т.д. Каждая связь считалась локализованной между двумя атомами и изображалась одной чертой, соединяющей эти атомы. Молекулы стали изображать с помощью структурных формул, получивших особенно широкое распространение в органической химии. Положения Бутлерова в дальнейшем легли в основу структурной теории, рассматривающей и пространственное расположение атомов в молекуле. Было найдено, что простые молекулы типа MXk с одинаковым центральным атомом M и разными заместителями Х имеют схожее геометрическое строение. Независимость геометрического строения от типа связи в широких пределах привела к мысли, что пространственное расположение атомов в молекулах MXk определяется ВАЛЕНТНОСТЬЮ центрального атома М и что эти ВАЛЕНТНОСТИ имеют направленный характер. Периодический закон Д. И. Менделеева (1869) вскрыл зависимость ВАЛЕНТНОСТИ элемента от его положения в периодической системе. Элементы одинаковых групп системы обладают одинаковой высшей ВАЛЕНТНОСТЬЮ, в большинстве случаев равной номеру той группы, в которой находится этот элемент; высшая ВАЛЕНТНОСТЬ меняется на 1 при переходе от одной группы к соседним. 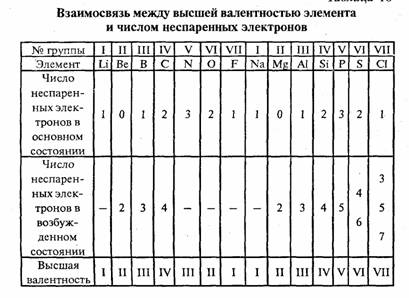 Эта зависимость сыграла чрезвычайно важную роль в развитии химии: зная лишь положение элемента (в том числе элементов, которые в то время ещё не были открыты) в периодической системе, можно было определить его валентные возможности, предсказать состав его соединений и впоследствии синтезировать их. С помощью представлений о формальной (стехиометрической) ВАЛЕНТНОСТИ химикам удалось обобщить и систематизировать огромный экспериментальный материал по строению, стехиометрическому составу и свойствам многих десятков и сотен тысяч органических и неорганических соединений. В таблице приведены некоторые примеры веществ с характерными для них валентностями:
Эта зависимость сыграла чрезвычайно важную роль в развитии химии: зная лишь положение элемента (в том числе элементов, которые в то время ещё не были открыты) в периодической системе, можно было определить его валентные возможности, предсказать состав его соединений и впоследствии синтезировать их. С помощью представлений о формальной (стехиометрической) ВАЛЕНТНОСТИ химикам удалось обобщить и систематизировать огромный экспериментальный материал по строению, стехиометрическому составу и свойствам многих десятков и сотен тысяч органических и неорганических соединений. В таблице приведены некоторые примеры веществ с характерными для них валентностями: 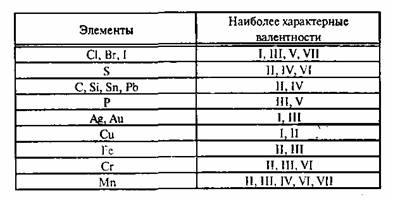
Первые электронные теории ковалентности и гетеровалентности. До электронных представлений о строении вещества ВАЛЕНТНОСТЬ трактовалась формально. Лишь в 20 в было установлено, что химическая связь осуществляется за счёт электронов внешних (валентных) оболочек атомовалентности.
В 1916 Г. Льюис ввел простой способ символического изображения электронов в химических формулах. Те электроны, которые, по его мнению, лежат на внешней оболочке,— а только их следует принимать во внимание при образовании связи — он обозначает точками, которые расставляет вокруг соответствующего химического символа. Электроны, являющиеся общими для двух атомов, изображаются точками, стоящими между этими атомами, причем эти точки располагаются ближе к тому химическому символу, который соответствует более электроотрицательному элементу. Как правило, пара точек, расположенных между символами, соответствует одному валентному штриху в обычном способе изображения. Каждая электронная пара, участвующая в образовании связи, представлена, следовательно, в виде валентного штриха, соединяющего символы, а электронные пары, не участвующие в образовании связи,— в виде более коротких штрихов, которые располагаются вокруг символа.
Для теории Льюиса — Лангмюра характерно то, что она в первую очередь занимается гомеополярными соединениями, в то время как теория Косселя, наоборот, исходит из гетерополярных соединений.
Рассматривая соединения, в которых элементы обнаруживают характерную для их места в периодической системе валентность, в общем как гетерополярные,
|

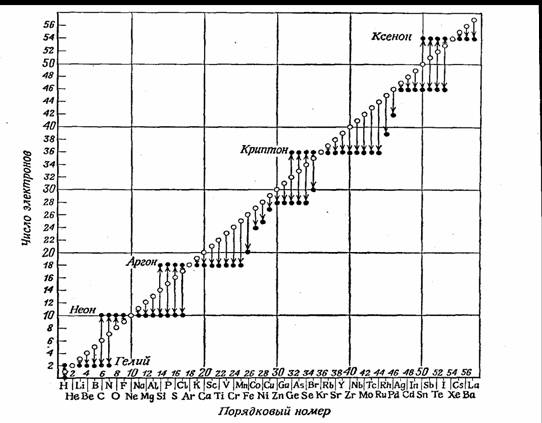
Коссель рассчитал для первых 57 элементов (до подгруппы лантаноидов) число электронов, которыми они обладают в тех соединениях, где они проявляют высшую отрицательную и высшую положительную валентности.
На оси абсцисс элементы расположены в соответствии с их порядковыми номерами и через равные промежутки; рассчитанное Косселем для каждого элемента число электронов нанесено в качестве ординаты и отмечено черной точкой. Те элементы, которые могут быть заряжены и отрицательно и положительно, имеют по две черные точки, которые конечно рас положены на одной вертикали одна над другой на расстоянии 8 единиц в соответствии с тем фактом, что сумма положительных и отрицательных высших валентностей равна 8, на что указывал еще Абегг. Кружки на рисунке соответствуют числу электронов у элементов в состоянии нейтральных атомов. В то время как эти числа естественно возрастают от элемента к элементу на одинаковую величину и соответственно этому лежат на прямой, расположенной под углом 45° к оси абсцисс, черные точки для элементов, расположенных рядом с инертными газами, все лежат на прямых, параллельных оси абсцисс, и находятся от нее на том же расстоянии, как и точка, обозначающая число электронов инертного газа, вокруг которого группируются элементы. Это значит, что число электронов, которыми обладают атомы элементов, стоящих рядом с инертными газами (т. е. элементов главных подгрупп периодической системы) в своих типичных соединениях, равно числу электронов ближайшего инертного газа.