Кислотно-основное состояние черноземов выщелоченных при длительном использовании в пашне северной лесостепи южного ЗауральяРефераты >> Ботаника и сельское хоз-во >> Кислотно-основное состояние черноземов выщелоченных при длительном использовании в пашне северной лесостепи южного Зауралья
Образующаяся в растворе соль хлористого алюминия относится к категории гидролитически кислых солей и в водном растворе расщепляется на кислоту и основание:
AlCl3 + 3H2O![]() Al(OH)3 + 3HCl.
Al(OH)3 + 3HCl.
В гумусовых горизонтах наибольшее значение в формировании кислотности принадлежит иону водорода, а в минеральных горизонтах – алюминию. Источником обменного иона водорода являются органические кислоты, образующиеся при разложении и гумификации органических остатков, а также угольная кислота. При взаимодействии с почвой, насыщенной основаниями, водород этих кислот внедряется в диффузный слой почвенных коллоидов:
[ППК-] Ca2+ + R(COOH)2![]() [ППК-] 2H+ + R(COO)2Ca;
[ППК-] 2H+ + R(COO)2Ca;
[ППК-] Ca2+ + H2CO3![]() [ППК-] 2H+ + CaCO3.
[ППК-] 2H+ + CaCO3.
Источником обменного алюминия следует считать алюминий кристаллической решетки глинистых минералов и несиликатные формы гидроокиси алюминия, мобилизуемые органическими кислотами и также внедряющиеся в диффузный слой почвенных коллоидов.
В зависимости от характера вытеснения различают две формы потенциальной кислотности – обменную и гидролитическую. Обменная кислотность проявляется при обработке почвы раствором нейтральной соли:
[ППК-] 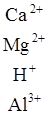 + 4KCl
+ 4KCl ![]() [ППК-]
[ППК-] 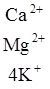 + HCl + AlCl3.
+ HCl + AlCl3.
Образующаяся в результате взаимодействия солевого раствора с почвой и гидролитического расщепления соляная кислота характеризует обменную кислотность. Величина обменной кислотности выражается в миллиграмм-эквивалентах Н+ и Аl3+, количество которых определяется методом титрования, или величиной рН солевой вытяжки, полученной при обработке почвы раствором нейтральной соли [3, 8].
Гидролитическая кислотность определяется как общая кислотность почвы, включающая в себя актуальную, обменную и «собственно» гидролитическую. Она значительно больше обменной и выражается в миллиграмм-эквивалентах на 100 г почвы. В отсутствие актуальной и обменной видов «собственно» гидролитическая кислотность не вредна для растений и микроорганизмов. Это наблюдается во всех черноземах, кроме южных [9].
С гидролитической кислотностью приходится встречаться чаще, чем с обменной, она свойственна большинству почв, даже черноземам. Эта кислотность включает менее подвижную часть поглощенных ионов Н+, труднее обменивающихся на катионы почвенного раствора. Определять ее необходимо для решения ряда практических вопросов применения удобрений – установления норм извести и возможности эффективного применения фосфоритной муки. При обработке почвы раствором уксуснокислого натрия в раствор переходят все содержащиеся в почве ионы водорода (и алюминия), т. е. определяется сумма всех видов кислотности (актуальная, обменная и гидролитическая). Чтобы определить величину собственно гидролитической кислотности, необходимо из общего показателя вычесть величину обменной кислотности. Обычно этого не делают и термином «гидролитическая кислотность» обозначают общую кислотность почвы, выражая ее в мг-экв на 100 г почвы.
Еще в начале XX века некоторые исследователи (Вейч в США, Дайкухара в Японии и, несколько позже, Каппен в Германии) обратили внимание на то, что в нейтрально солевых вытяжках из кислых почв присутствует Аl, и приняли за причину обменной кислотности наличие Аl среди поглощенных катионов почвы. Как уже указывалось выше, реакция нейтральной соли с кислой почвой, содержащей Аl на поверхности коллоидных частиц, представляется в следующем виде:
АlСl являясь гидролитически кислой солью, подкисляет раствор:
АlСl3 +3Н2О → Аl(ОН)3+3НCl.
Мера подкисления определяется титрованием:
АlСl3+NaОН → Аl(ОН)3 + 3NаСl.
Иное представление о природе почвенной кислотности поддерживалось К.К. Гедройцем, который считал причиной кислотности наличие в почве обменного Н+. Возражая Дайкухара и Каппепу, К.К. Гедройц (1930) объяснял появление Аl в фильтрате вторичной реакцией между НСl (продуктом взаимодействия кислой, т, е. содержащей обменный Н-ион почвой и нейтральной солью) и основными формами Аl твердой фазы почвы, легко вступающими в реакцию.
Взгляды Гедройца на вторичное происхождение Аl при взаимодействии почв с растворами нейтральных солей разделяли многие крупные исследователи в области химии почвы (Вигнер, 1930; Гиссинк, 1925 и др.). В дальнейшем к ним присоединился и Каппен (1929).
Представление о наличии водородного иона среди обменных катионов подтверждалось рядом явлений. Прежде всего, водородный ион, постоянно появляющийся в почве (в результате биологических процессов образования угольной кислоты, азотной кислоты, органических кислот), служит несомненным первичным фактором подкисления. Значение его усиливается тем, что протон (ион Н+) обладает наибольшей из всех ионов подвижностью и высокой способностью адсорбироваться. Во многих кислых почвах, прежде всего в почвах или почвенных горизонтах, богатых органическим веществом, в большинстве случаев отсутствует эквивалентность между кислотностью и количеством Аl в растворе: кислотность этих почв, определяемая титрованием вытяжек, больше, чем количество Аl, найденное в вытяжках. Суспензии кислых почв в исследованиях Раис и Осуги (1918) вызывают инверсию сахара, что считалось доказательством наличия в них Н, являющихся катализаторами реакции инверсии. Все эти (и некоторые другие) факты привели в 30-х годах исследователей в области химии почвы к сравнительно единодушному представлению о наличии Н+-иона па поверхности почвенных частиц, как об единственной причине обменной кислотности.
Сравнивая поглощение Аl из 0,05 н. растворов: 1) АlСl3; 2) АlСl3, нейтрализованного на 1/3 NаОН, т. е. содержащего Аl(ОН)2+, и 3) АlСl3, нейтрализованного на 2/3 NаОН, т. е. содержащего Аl(ОН)+2,– Чернов обнаружил еще более высокую адсорбционную способность у основных форм алюминия по сравнению с трехвалентными ионами. Видимо, решающую роль здесь играет слабая диссоциированность соединений, которые образуют ионы, включающие Аl, с ионами потенциал-определяющего слоя. Вторым моментом, подкрепляющим точку зрения Чернова, является эквивалентность между титрирной кислотностью КCl – вытяжек из кислых почв и содержанием Аl в этих вытяжках (за отмеченными выше исключениями: лесной подстилки; торфянистых почв; верхних горизонтов подзолистых почв). При обмене же равновалентных ионов разведение не влияет на количество адсорбированных ионов. Чернов использовал это положение для суждения о том, Н+ или Аl3+ обмениваются. с К+ солевого раствора при определении кислотности. В его опытах разведение раствора КCl приводило к резкому снижению величины определяемой кислотности, что принималось за подтверждение участия в обмене Аl-иоиов.
Однако все данные В. А. Чернова относятся к вытяжкам из почв и не являются прямым доказательством присутствия Аl среди обменных катионов. Работы В.А. Чернова вызвали оживленную дискуссию (Аскинази, Карпинский и Ремезов, 1955; Ярусов и Соколова, 1950; Моисеев, 1954). Доказательства присутствия Аl среди обменных катионов были получены лишь в самые последние годы в опытах, проводившихся с использованием обмеппо-способных смол. В опытах Харуорд и Колеман ( 1954) катионит насыщался в одном случае Аl путем промывания раствором АlСl3, в другом случае – Н-ноном путем промывания нормальным раствором НCl. Поскольку катионит представляет собой органическое вещество, появление Аl при промывке его НCl невозможно. С этими двумя образцами смол сравнивались по теплоте нейтрализации образцы различно подготовленных глин. Глина, промытая 1 н. НCl или пропущенная через колонку Н+-смолы, показала ту же величину теплоты нейтрализации, что и Н+-смола, т. е. оказалась насыщенной Н+-ионом.
