Ациклические непредельные углеводороды (алкены)
- Связь менее прочна, чем - связь, так как p- орбитали с параллельными осями перекрываются значительно меньше, чем при образовании теми же p- орбиталями и s- орбиталями - связи (перекрывание осуществляется по оси орбиталей). В связи с этим, - связь легко разрывается и переходит в две новые - связи посредством присоединения по месту двойной связи двух атомов или групп атомов реагирующих веществ.
Иными словами, для алкенов наиболее типичными являются реакции присоединения.
В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
1) Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к дигалогенопроизводным алканов, содержащим атомы галогена у соседних углеродных атомов.
H2C=CH2 + Br2 BrCH2–CH2Br(1,2-дибромэтан)
Приведенная реакция - обесцвечивание алкеном бромной воды является качественной реакцией на двойную связь.
2) Гидрирование. Алкены легко присоединяют водород в присутствии катализаторов (Pt, Pd, Ni), образуя предельные углеводороды.
CH3–CH=CH2 + H2 ––Ni CH3–CH2–CH3(пропан)
3) Гидрогалогенирование. Этилен и его гомологи присоединяют галогеноводороды, приводя к галогенопроизводным углеводородов.
H2C=CH2 + HBr CH3–CH2Br(бромистый этил)
Присоединение галогеноводородов к пропилену и другим алкенам происходит в соответствии с правилом В.В.Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи).
|
CH3−CH=CH2 + HCl CH3− |
CH−CH3(2-хлорпропан) I Cl |
4) Гидратация. В присутствии минеральных кислот олефины присоединяют воду, образуя спирты.
|
OH I | ||
|
CH3− |
C=CH2(2-метилпропен-1) + H2O ––H+ CH3− |
C−CH3(2-метилпропанол-2) |
|
I CH3 |
I CH3 |
5) Сульфатация (O- сульфирование). Взаимодействие алкенов с серной кислотой приводит к кислым эфирам серной кислоты.
|
CH2=CH−CH3 + HO−SO2−OH CH3− |
CH−O−SO2−OH(изопропилсерная кислота) I CH3 |
Как видно, направление реакций гидратации и сульфирования также определяется правилом Марковникова.
6) Окисление. Алкены легко окисляются. В зависимости от условий проведения реакции образуются различные продукты.
a) При сжигании на воздухе олефины дают углекислый газ и воду.
H2C=CH2 + 3O2 2CO2 + 2H2O
b) При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли (реакция Е.Е.Вагнера). Реакция протекает на холоде.
|
3H2C=CH2 + 2KMnO4 + 4H2O 3 |
CH2−CH2(этиленгликоль) + 2MnO2 + 2KOH I I OH OH |
В результате реакции наблюдается обесцвечивание раствора перманганата калия. Реакция Вагнера служит качественной пробой на двойную связь.
c) При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи и образование кислот или кетонов.
|
O II |
O II | |
|
CH3−CH=CH−CH2−CH3(пентен-2) –[O] CH3− |
C (уксусная кислота) + |
C−CH2−CH3(пропионовая кислота) |
|
I OH |
I OH |
|
O II | |||
|
CH3− |
C=CH−CH3(2-метилбутен-2) –[O] CH3− |
C=O(пропанон-2) + |
C−CH3(уксусная кислота) |
|
I CH3 |
I CH3 |
I OH |
6. Применение алкенов
Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры гликолей и пр.), полимеров (полиэтилен, поливинилхлорид, полиизобутилен и др.), а также многих других важнейших продуктов.
Номенклатура
В алкенах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится двойная связь. В названии соответствующего алкана окончание -ан заменяется на -ен. В разветвленных алкенах выбирают главную цепь так, чтобы она содержала двойную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение двойной связи, например:
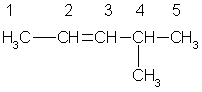
4-метил-2-пентен
