Биоразлагаемые полимерные материалы
В Институте биохимии им. А.Н. Баха РАН разработана схема биотехнологического производства одного из полигидроксиалканоатов — полигидроксибутирата (ПГБ) на основе штамма-продуцента Azotobacter chroococcum (Пат. 2194759 РФ, Пат. 2201453 РФ), способного синтезировать до 85 % полимера от сухого вещества клеток.
В качестве растворителей для экстракции воды из сырой биомассы по литературным и патентным данным предлагаются низкокипящие эфиры, кетоны, парафины, спирты алифатического или ароматического типов (Пат. 6043063 США). Обработку сырой биомассы, содержащей целевой продукт — ПГБ. проводят органическим растворителем, не растворяющим ПГБ. с целью его освобождения от воды, липидов (жирных кислот, стеринов), неорганических солей и других примесей. Отделение осадка — клеточной массы, содержащей ПГБ, проводится известными способами — фильтрацией или центрифугированием с последующим удалением растворителя сушкой.
С точки зрения экономической и технической доступности, незначительной летучести и достаточно низкой температуры очистки оборотного спирта на этой стадии очистки сырой биомассы был выбран изопропиловый спирт.
Очистку сухой биомассы, содержащей ПГА, проводили с использованием в качестве экстрагирующего растворителя галоидированных углеводородов: 1,2-дихлорэтан, хлороформ (ЕР 0015123); 1.1,2-трих-лорэтан; 1.1,2,2-терахлорэтан (ЕР 0015123, ЕР 0015669); метиленхлорид (Пат. 4310684 США). Применение метиленхлорида (температура кипения 40 — 41 °С) по сравнению с хлороформом (температура кипения 61 °С) вследствие его большей летучести приводит к увеличению потерь растворителя при перегонке или центрифугировании. Известно, что в качестве растворителей применяются метил- и этиллактаты (Заявка 4036067 ФРГ). Однако лактаты имеют температуру кипения 154 ºС, что требует применения высокой температуры для удаления растворителя. При этом возможен гидролиз ПГБ с уменьшением молекулярной массы, что нежелательно. Наибольший выход очищенного продукта получается при использовании хлороформа, поэтому при очистке сухой биомассы нами был выбран именно этот растворитель.
Сырая биомасса была изготовлена в Институте биохимии им. А.Н. Баха РАН на оборудовании ООО "Фирма "Макофарм" (г. Лотошино) и содержала 73 % полимера (в расчете на сухую биомассу), 0,52 % азота (1,73 % на сухой остаток). Очистку сырой биомассы, выделение и очистку ПГБ проводили в соответствии со схемой, представленной на рис. 1. С целью сокращения количества свободной воды, содержащейся в сырой биомассе, и уменьшения изопропилового спирта для ее экстракции опробованы предварительная сушка и вакуумная фильтрация биомассы. Сушку проводили при температуре 50 — 60 "С в течение 1 — 3 ч и остаточном давлении 1—2 мм рт. ст. Установлено, что величина вакуума в заданном интервале температур не влияет на количество удаляемой воды. Температура также не оказывает практически никакого влияния, главным является время сушки. Так, количество удаленной влаги за 2 ч составило 51,8 %, за 3 ч — 57,7 %.
Исследованы более мягкие условия удаления воды из сырой биомассы путем фильтрации при температуре окружающей среды 18 — 25 °С и остаточном давлении 10 — ПО мм рт. ст. на воронке Бюхнера через различные фильтровальные материалы (бязь, капрон). Через 2 ч фильтрации удалялось 43,9 % воды вместо 30 при повышенной температуре. Следовательно, значительное количество воды можно удалить при более низкой температуре. Для промывки высушенной биомассы использовали на 30 % меньше изопропилового спирта, чем для продукта с содержанием воды 75 %.
Содержание липидных соединений в использованном изопропиловом спирте от первой и второй промывок было одинаковым для исходной биомассы и биомассы после частичного удаления воды и составляло 0,3 и 0,25 %. Следовательно, несмотря на меньшее количество изопропилового спирта, взятого на промывку, экстракция липидных соединений происходила одинаково.
Данные, полученные на образце с молекулярной массой 500000, были проверены и подтверждены на образце с молекулярной массой 980000.
По результатам аналитического контроля содержания азота, золы и сухого остатка в сырой биомассе было установлено, что требуется не менее трех промывок изопропиловым спиртом. Оборотный изопропиловый спирт подвергался очистке перегонкой и по качеству соответствовал ГОСТ 9805-84 марки "технический" с содержанием 8,6 % воды при норме 13 %. Остальные стадии процесса очистки биомассы (сушка, дробление) проводились традиционным способом.
Далее исследовали выделение ПГБ и его очистку от клеточной массы при использовании хлороформа в качестве экстрагента (табл. 1).
Из данных табл. 1 следует, что концентрация ПГБ в растворе хлороформа составляла 0,5 — 0,25 %, что зависело от величины вакуума при фильтрации, а при глубоком вакууме и длительной фильтрации — от потерь растворителя. Увеличение количества клеточной массы на фильтре приводит к увеличению времени фильтрации, поэтому на данном фильтре можно проводить не более трех операций фильтрации. Эти результаты были учтены при создании опытной установки (рис. 2). Что касается концентрации ПГБ в клеточной массе, то судя по его содержанию при указанных параметрах, полимер оставался в клеточной массе. С целью выделения ПГБ и уменьшения его потерь была осуществлена четвертая дополнительная промывка клеточной массы хлороформом.
Количественное выделение ПГБ осуществляли путем дозирования раствора ПГБ в хлороформе в изопропиловый спирт (объемное соотношение 1:3) при постоянном перемешивании реакционной массы (табл. 2).
Как следует из табл. 2, технологический процесс высаждения полимера хлороформом из сухой биомассы и его промывки изопропиловым спиртом позволяют получить ПГБ высокой степени чистоты, требуемой для медицинской промышленности (Пат. 2333962 РФ).
Контроль исходных, промежуточных и конечных продуктов в процессе выделения и очистки ПГБ из сырой биомассы проводили в соответствии со схемой, представленной на рис. 3.
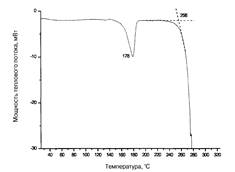
Состав исходной сырой биомассы, а также продуктов, образующихся в процессе её очистки, исследовали методом ИК-спектроскопии. ИК-спектры снимали на Фурье-спектрофотометре фирмы PerkinElmer(США) 1710 области 4000 -400 см-1 в виде таблеток, запрессованных с КВт для твердых образцов, и в виде пленок, нанесенных на окошки KRS-5 или КВт для жидких (рис. 4). Содержание азота определяли по методу Кьельдаля, температуру и теплоту плавления образцов ПГБ — методом дифференциальной сканирующей калориметрии на приборе PerkinElmerDiamondDSC. Зольность оценивалась по ГОСТ 15973-82. Сухой остаток определяли сушкой при температуре 105 °С до постоянной массы, содержание воды в растворителях — методом кулонометрического титрования с реактивом Фишера на влагомере мод. СА-02 фирмы Mitcubsi(Япония).
ИК-спектр сырой биомассы (рис.4, а) аналогичен спектру, приведенному в атласе Хюммеля. Отличие в спектре сырой биомассы наблюдается только в области поглощения гидрок-сильных групп воды, см': 3600 - 3400 (v ОН); 1640 (5 ОН); 700 - 600 (б ОН). После сушки образца интенсивность полос в области 3600 - 3400 и 1640 см-1 резко уменьшается, широкое поглощение в области 600 — 700 см1 исчезает. В ИК-спектре образца высушенной биомассы помимо основных полос, характерных для ПГБ, присутствуют дополнительные: 3300; 1650 и 1520 см1; изменяется соотношение полос 1229 и 1185 см1. Можно предположить, что наличие данных полос в спектре связано с присутствием в исследуемом продукте веществ с амидными группами (3300, 1650, 1520 см') и органическими фосфатами (1180 см1).
