Влияние кислорода на активность нанесенного ванадиевого катализатора в процессе газофазной полимеризации этилена
Каталитические системы циглеровского типа отличаются высокой чувствительностью к примесям кислорода. На примере гомогенных каталитических систем на основе соединений титана [1, 2] и ванадия [3, 4] и гетерогенных титановых катализаторов [5, 6] показано, что под действием кислорода может происходить активация и ингибирование процесса полимеризации, меняется ММ и стереорегулярность полимерных продуктов.
В литературе нет сведений о влиянии кислорода на полимеризацию с катализаторами, закрепленными на носителе. В связи с тем, что в производстве полиолефинов и наполненных полимерных материалов все более широкое распространение получают процессы газофазной полимеризации с использованием нанесенных катализаторов, в настоящей работе была поставлена задача исследовать влияние кислорода на активность нанесенного ванадиевого катализатора при полимеризации этилена в отсутствие растворителя.
Кинетику газофазной полимеризации этилена изучали в стеклянной вакуумной установке [7]. Полимеризацию осуществляли в термостатируемом реакторе объемом 400 мл, снабженном двумя отростками для раздельного введения нанесенного ванадиевого катализатора и алюминийорганического соединений (в парообразном состоянии). В ходе полимеризации давление мономера и скорость перемешивания реакционной массы поддерживали постоянными.
Ванадиевый катализатор был получен нанесением VC14 на неорганический носитель — перлит (фракция с размером частиц 0,2 мм) по методике, разработанной в ИХФ АН СССР [8]. Содержание ванадия на носителе, определенное колориметрическим методом [9], менялось от 0,27 до 0,55 вес.%; валентное состояние ванадия, по данным потенциометрического титрования, было равно 3.
В качестве сокатализатора использовали А1(изо-С4Н3)з (А1(изо-Вu)3) (т. кип. 39-40°/0,65 гПа). По анализу содержание А1 13,65, содержание изо-Вu-группы 85,4 вес.%.
Этилен подвергали низкотемпературной разгонке и пропускали через колонку с пиролюзитом для очистки от примеси кислорода. Количество кислорода в очищенном этилене по данным колориметрического анализа составляло менее 5 млн. долей.
Кислород, использованный для добавок, был получен разложением КМnСr.А1(изо-Вu)2(ОВu-изо) синтезировали из А1(изо-Вu)з и абсолютного изобутилового спирта. Содержание изо-Вu-групп в диизобутилалюминийизобутоксиде, по данным хроматографического анализа, составляло 58 вес.%; мольное отношение (OBu-изо): (изо-Bu), рассчитанное из ПМР-спектров, равнялось 0,46. Полимеризацию с А1 (изо-Вu)2(ОВu-изо) осуществляли в среде сухого спектрально чистого н-гептана.
В присутствии каталитической системы VCL/перлит — А1 (изо-Вu)3 про-цесс газофазной полимеризации этилена носит нестационарный характер. Активность катализатора, максимальная в начальный момент времени, снижается в ходе полимеризации и достигает постоянного значения (рис. 1).
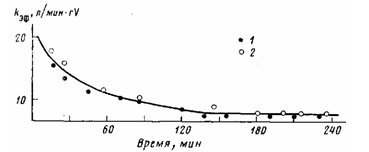
Рис. 1. Изменение эффективной константы скорости полимеризации этилена во времени в присутствии катализатора УС14/перлит — Al (изо-Bu) з. 70°, Al: V=22, [С2Н4] =0,018 моль/л, содержание ванадия на носителе 0,55 вес.%. Содержание кислорода в этилене 5 (1), 280 млн. долей (2)
В исследованных условиях (70°, содержание ванадия на носителе 0,27—0,55 вес.%, мольное отношение Al: V=5—40) эффективная константа скорости полимеризации каф, определяемая как скорость полимеризации, рассчитанная на единицу концентрации мономера и 1 г переходного металла, не зависит от содержания ванадия в нанесенном катализаторе и мало меняется с увеличением мольного отношения Al : V и с изменением порядка подачи компонентов катализатора и мономера в реакционную зону.
Эффекты, наблюдаемые при введении кислорода в процессе полимеризации, обусловлены протеканием химических реакций кислорода либо с исходными компонентами катализатора, либо с продуктами их взаимодействия. Поэтому при изучении влияния кислорода на каталитическую активность количество добавки целесообразно определять не только абсолютной концентрацией кислорода, но и отношением концентраций кислорода и каждого из компонентов катализатора, т. е. мольным отношением 02: V и О2: AI. Добавки кислорода вводили в реакционную зону на стадии формирования каталитических центров и в ходе полимеризации.
В первом случае проводили предварительное взаимодействие одного из компонентов катализатора с кислородом (в течение 5 мин), затем в систему вводили второй компонент и мономер. Условно такой порядок подачи реагентов можно обозначить [А1(изо-Вu)3+О2]+V (I) и [V+О2] + +А1(изо-Вu), (II).
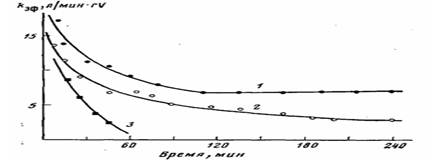
Рис. 2. Кинетические кривые полимеризации этилена на нанесенном ванадиевом катализаторе при различных концентрациях кислорода для системы I. 70°, Al: V= •=18-23, [С2Н4] =0,018 моль/л, содержание ванадия на носителе 0,27 вес.%- 02: А1=0 (1); 0,1 (2); 0,15 (3)
Рис. 2 демонстрирует влияние добавок кислорода на процесс полимеризации для системы I. Из рисунка видно, что с увеличением мольного отношения О2: А1 снижается каталитическая активность, меняется характер кинетики полимеризации, т. е. резко ускоряется дезактивация катализатора. При мольном отношении О2: А1=0,2 (соответственно 0,2 об.% О2) система I полностью теряет каталитическую активность.
Известно, что окисление алюминийтриалкилов кислородом приводит к образованию их алкоксипроизводных [10, 11]. Реакция протекает через стадии образования высокореакционноспособных перекисных соединений алюминия и их превращений. При температурах выше 20° основным продуктом реакции является моноалкоксид алюминия. На примере титановых катализаторов показано, что системы, включающие в качестве сокатализа-тора алкоксипроизводные триэтилалюминия, либо характеризуются низкой каталитической активностью [11], либо не активны в полимеризации [12].
В настоящей работе с целью установления причин дезактивации системы I исследовали продукт окисления Аl(изо-Ви)3 — диизобутилалюми-нийизобутоксид как сокатализатор с VCL/перлит. Методика эксперимента не позволяла осуществлять полимеризацию в газовой фазе из-за низкой упругости паров А1(изо-Вu)2(ОВu-изо) (т. кип. 120°/0,65 гПа), поэтому опыты проводили в к-гептане. Подобное различие в скоростях полимеризации в жидкой и газовой фазе отмечается также Кейи [13] при полимеризации пропилена с <x-TiCl3 — AlEt2Cl.
Полученные экспериментальные результаты по полимеризации этилена с А1(изо-Вu)2(ОВu-изо) приведены на рис. 3 и сводятся к следующему: катализатор УС14/перлит не обладает каталитической активностью в сочетании с А[(изо-Вu)2(ОВu-изо); добавки А1(изо-Вu)2(ОВu-изо) на стадии формирования активных центров в виде смеси с А1(изо-Вu)3 при одной и той же концентрации триизобутилалюминия (рис. 3, кривые 3, 4) и в ходе полимеризации (рис. 3, кривая 5) приводят к снижению начальной скорости полимеризации и ускорению дезактивации катализатора. На основании этих результатов, исходя из представлений о биметаллической природе активных центров, можно высказать следующие предположения: во-первых, Al(uзo-Bu)2(OBu-uзo) не является алкилирующим агентом и его действие ограничивается образованием комплексов с исходными и алки-лированными соединениями ванадия; во-вторых, образующиеся комплексы являются, пo-видимому, более прочными, по сравнению с комплексами, включающими А1(изо-Вu)3 (из-за сильных донорных свойств А1(изо-Вu)2-(ОВu-изо) [14, 15]); диизобутилалюминийбутоксид может замещать А1(изо-Вu)3 в ванадий-алюминиевых комплексах; в-третьих, комплексы A1(изо-Bu)2(OBu-изо) с алкилированным ванадием неактивны в процессе полимеризации этилена.
