Влияние концентрации аниона хлора на адсорбцию органического соединения реакционной серии оксиазометина на цинковом электроде
Галогеноводородные кислоты интенсивно действуют на алюминий, степень их агрессивности снижается согласно следующему ряду: НF - НCL – НBr – НI. В фосфорных и уксусных кислотах при комнатной температуре алюминий достаточно устойчив. Муравьиная, щавелевая, хлорорганические кислоты разрушают алюминий.
Серьёзные разрушения алюминия вызывают хлорсодержащие органические растворители, даже безводные, например CCL4, разрушают алюминий:
2Al + 6CCl4 ↔ 3C2Cl6 + 2AlCl3
Алюминиевые сплавы обладают меньшей коррозионной стойкостью, чем алюминий.
Контакт алюминия и его сплавов с другими металлами может вызвать интенсивную коррозию, особенно в растворах электролитов или в очень влажной атмосфере, поскольку большинство металлов является катодами в отношении к алюминию. Особенно опасен для алюминия и его сплавов контакт с медью, сплавами меди и нержавеющих сталями.
Цинк . Нормальный электродный потенциал цинка – 0,76В. В качестве конструкционного материала цинк не применяется. А используется для защиты от коррозии железоуглеродных сплавов. При нагревании в воде цинк устойчив, исключая интервал температур 50-80°С , когда на поверхности металла образуется рыхлая плёнка Zn(OH)2, которая отслаивается от поверхности. В растворах солей с более электроотрицательным катионом цинка устойчив. Присутствие в растворах более положительного катиона приводит к разрушению цинка:
Zn + FeSO4 ↔ Fe + ZnSO4
В растворах щелочей (рН>12) и кислот цинк неустойчив, но он обладает высокой стойкостью в нейтральных и слабощелочных средах в связи с образованием на поверхности Zn(OН)2.
2 Экспериментальная часть
2.1 Объекты исследования
В качестве ингибиторов коррозии цинка в 1 М растворе H2SO4 исследовали РС оксиазометина.
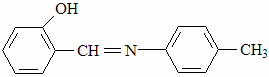
Изучали влияние адсорбции не замещённого оксиазометина хлорид анионов, которые вводили в ингибированный раствор H2SO4 в виде КCL на фоне постоянной (10 моль/л)
Концентрации органического оединения варьировали в пределах от 0.25 до 0.0625 моль/л.
Приготовление рабочих растворов.
Для проведения опытов использовали 1М водные растворы H2SO4.
2.2 Подготовка металлических образцов к импедансным измерениям
Использовали нарезанный листовой цинк, размеры которого замеряли штангенциркулем. Электроды полировали стеклянным порошком до зеркального блеска, промывали дистиллированной водой, обезжиривали спиртом, осушали фильтровальной бумагой и использовали для определения адсорбции органических соединений.
2.3 Методика емкостных измерений
Исследования проводили в 3-х электродной ячейке при постоянной (22°С) температуре при помощи моста переменного тока Р-5021.
Вспомогательным электродом в цепи измерения ёмкости служил платиновый электрод цилиндрической формы. Раствор H2SO4, залитый в ячейку, в течении 15 минут барбатировали электролитически очищенным водородом. Измерения проводили при частотах 1 кГц и 20 кГц при стационарном потенциале относительно хлоридсеребряного электрода сравнения при последовательном соединении ёмкости и сопротивления.
Измеренные значения ёмкости пересчитывали на параллельную схему по формуле
Cп / S = Cи / 1 + ( Rи - Rо )² w² C²и (1)
По формуле (2) рассчитывали степень заполнения поверхности электрода добавками Θ :
Θ = ( Со – Си ) / Со (2)
где Со, Си – ёмкости двойного электрического слоя, соответственно, в растворе фона и в присутствии ингибитора.
|
Среда С(КCL) м/л |
Сп/S μФ/см² |
Θ (H2SO4) Фон 1 |
КΘ (H2SO4) |
Θ (ПАВ) Фон2 |
КΘ (ПАВ) |
|
1М H2SO4 Фон 1 |
- |
14,16 |
- |
- |
- |
|
H2SO4 + ПАВ (СН3) Фон 2 |
4,85 |
0,657 |
2,91 |
- |
- |
|
0,25 |
3,76 |
0,734 |
3,76 |
0,225 |
1,29 |
|
0,125 |
3,10 |
0,781 |
4,57 |
0,361 |
1,56 |
|
0,06 |
2,45 |
0,827 |
5,78 |
0,495 |
1,98 |
|
0,03 |
2,35 |
0,834 |
6,02 |
0,515 |
2,06 |
|
1 кГц |
20 кГц | |||||
|
С μФ |
G mS |
С μФ |
G mS |
Сп/μ |
Сп/S μФ/см² | |
|
1М H2SO4 Фон 1 |
2,7; 2,3; 2,22 |
21; 23; 22 |
0,38 |
208 |
1,77 |
14,16 |
|
H2SO4 + ПАВ (СН3) Фон 2 |
0,74 |
9 |
0,25 |
92 |
0,61 |
4,8 |
|
С(КCL) м/л |
0,68; 0,62; 0,58 |
6; 6,6 |
0,26 |
94,4 |
0,47 |
3,76 |
|
0,25 | ||||||
|
0,125 |
0,56; 0,51; 0,49 |
5 |
0,26 |
99 |
0,387 |
3,10 |
|
0,06 |
0,44; 0,39; 0,38 |
4 |
0,24 |
99 |
0,305 |
2,45 |
|
0,03 |
0,4; 0,38; 0,37 |
4 |
0,25 |
100 |
0,293 |
2,35 |
