Дегазация воды
1. Классификация методов дегазации воды, теоретические основы процесса
Удаление из воды растворенных в ней или образующихся в процессе ее обработки газов называют ее дегазацией. Обычно из воды приходится удалять углекислоту, сероводород, кислород и реже метан. Первые три коррозионно-активных газа обусловливают либо катализируют процессы коррозии металла, а диоксид углерода(IV) вызывает коррозию бетона. Метан, выделяющийся из воды в процессе ее обработки, образует с воздухом в помещении водоочистного комплекса взрывоопасную смесь, а сероводород придает воде неприятный запах. Кроме того, при водород-катионитовом умягчении и ионитовом обессоливании воды, а также при обезжелезивании и деманганации подземных бикарбонатных вод приходится решать задачу удаления свободной углекислоты. При подготовке питательной воды, а также воды теплоцентралей необходимо удалять из нее кислород в целях предотвращения коррозии металла. Отсюда становится очевидной необходимость возможно полного удаления из воды растворенных в ней газов. Существующие методы дегазации воды подразделяют на физические и химические. Сущность физических методов дегазации заключается в следующем: вода, содержащая удаляемый газ, приводится в соприкосновение с воздухом, если парциальное давление этого газа в воздухе близко к нулю; создаются условия, при которых растворимость газа в воде становится ничтожно малой. С помощью первого приема, аэрации воды, обычно удаляют свободную углекислоту и сероводород, поскольку парциальное давление этих газов в атмосферном воздухе близко к нулю. Ко второму приему обычно прибегают при обескислороживании воды. В этом случае ввиду значителнього парциального давления кислорода в атмосферном воздухе аэрацией воды кислород удалить нельзя, поэтому воду доводят до кипения, тогда растворимость всех газов в ней падает до нуля. Для этого применяют либо нагревание воды, либо понижение давления до величины, при которой вода кипит без дополнительного подогрева в вакуумных дегазаторах. В настоящее время наиболее распространенной теорией, объясняющей механизм передачи вещества между жидкой и газообразной фазами в процессе десорбции, является теория двухслойного поглощения, согласно которой десорбция сводится к последовательной диффузии удаляемого газа через два пограничных слоя — жидкостный и газовый. При диффузии газа из жидкой фазы в газообразную концентрация его и парциальное давление изменяются в диффузионных пленках. Концентрация газа в жидкой фазе равна концентрации его на границе между жидкостной пленкой и основной массой жидкости; в жидкостной пленке происходит снижение концентрации от величины С1 до С2, отвечающей парциальному давлению р2 диффундирующего газа на границе раздела фаз; в газовой пленке парциальное давление диффундирующего газа изменяется от величины р2 до величины р1 имеющей место на границе газовой пленки и основной массы газа, в которой парциальное давление диффундирующегго газа также равно величине р1.
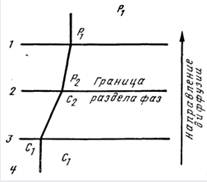
Рис. 19.1. Схема изменения давлений и концентраций газа на границе раздела фаз: 1,4 — газообразная и жидкостная фазы; 2, 3 — газовая и жидкостная диффузионная пленка
По теории двухслойного поглощения, общее сопротивление десорбции R равно сумме сопротивлений, оказываемых пограничными диффузионными слоями:
R = R1+ R2(19.1)
где R1 — сопротивление жидкостного пограничного слоя; R2 — сопротивление газового пограничного слоя.
Величины, обратные сопротивлениям в пограничных слоях, называют частными или пленочными коэффициентами десорбции:
![]() (19.2)
(19.2)
Численно частный коэффициент десорбции равен количеству удаляемого (десорбируемого) газа, передаваемого через единицу площади соприкосновения фаз в единицу времени при движущей силе в диффузионной пленке, равной единице.
Скорость процесса десорбции растворенного в воде газа в воздух определяется из выражения
![]() (19.3)
(19.3)
где Т — время, ч; А — площадь соприкосновения жидкой и газообразной фаз, м2; G — количество десорбируемого газа, кг/ч.
При малой концентрации десорбируемого газа в воде скорость процесса десорбции определяется средней движущей силой ΔСср и сопротивлением процессу диффузии в пленке жидкости Кж
![]() (19.4)
(19.4)
Согласно теории двухслойного поглощения, количество десорбируемого газа
![]() (19.5)
(19.5)
где Ко — общий коэффициент десорбции, м/ч, который для случая десорбции труднорастворимых газов может быть приравнен к пленочному коэффициенту в жидкостной пленке Кж, А — площадь соприкосновения жидкой и газообразной фаз, м2; ΔСср — средняя движущая сила процесса десорбции, кг/м3, которую для случаев десорбции из малоконцентрированных растворов газов подсчитывают по уравнению
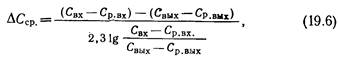
здесь Свх и Свых — концентрации удаляемого газа в воде соответственно на входе ее в аппарат и на выходе из него; Ср.Вх и Ср.вых — равновесные концентрации удаляемого газа в воде соответственно при входе ее в аппарат и на выходе из него.
Таким образом, величина ΔСср зависит от разности концентраций удаляемого газа в воде и воздухе.
Основное расчетное уравнение аппаратов для извлечения из воды растворенных газов десорбцией записывается в следующем виде:
![]() (19.7)
(19.7)
![]()
где q — производительность аппарата, м3/ч.
Коэффициент сопротивления процессу диффузии в пленке жидкости Km возрастает с увеличением относительной скорости движения воды и воздуха в десорбере, с повышением температуры и увеличением коэффициента диффузии удаляемого газа.
Из величин, входящих в общее уравнение десорбции, G и ΔССр, могут быть подсчитаны по заданным условиям работы дегазатора, величина Km вычислена опытным путем или с помощью теории подобия. Это уравнение является основным для расчета десорбционных аппаратов. Из него находят необходимую поверхность соприкосновения жидкой и газообразной фаз для обеспечения заданного эффекта дегазации, а, следовательно, и размер проектируемых аппаратов.
Для удаления из воды растворенных газов применяют несколько типов дегазаторов: пленочные с различного рода насадками, работающие в условиях противотока дегазируемой воды и воздуха, подаваемого вентилятором, барботажные, пенные, вакуумно-эжекционные, вакуумные.
2. Химические методы дегазации воды
В основе химических методов удаления из воды, растворенных газов лежит их химическое связывание, достигаемое введением реагентов или фильтрованием через специальные загрузки. Для удаления из воды кислорода применяют ее фильтрование через легко окисляющиеся вещества, например, через стальные стружки, и обработку сульфитом натрия или оксидом серы(1У).
