Енолят-анионы и енамины. Таутомерия. Альдольные реакции
Карбонильная группа полярна и частично положительный заряд с ее атома углерода передается на соседний (a-атом) углерода, делая соединенные с ним атомы водорода подвижными.
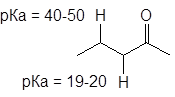
Альдегиды и кетоны могут проявлять, таким образом, свойства С-Н-кислот. Конечно, кислотность карбонильных соединений очень мала, тем не менее именно кислотностью a-атомов водорода объясняются многие их химические свойства. Кислотность a водородов в альдегидах и кетонах объясняется, прежде всего, тем, что при этом анион, образующийся из них при отщеплении протона, стабилизирован резонансом. Отрицательный заряд в нем делокализован.
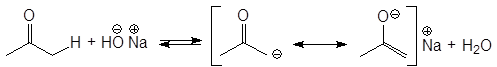 (1)
(1)
енолят-анион
Резонансно стабилизированный анион может присоединять протон или к атому углерода или к атому кислорода. В первом случае образуется кетонная форма, а во втором енольная форма.
Енолят-анионы могут реагировать с алкилгалогенидами по механизму SN2
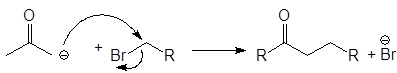 (2)
(2)
или с альдегидами и кетонами
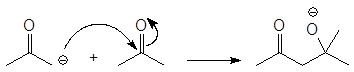 (3)
(3)
енолят-анион кетон тетраэдральный промежуточный
продукт присоединения
к карбонильной группе
Таутомерия
Итак, подвижный атом водорода, хотя и очень медленно может переходить к кислороду с образованием, так называемой, енольной формы:
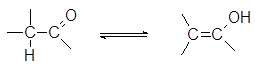 |
Кетонные и енольные формы карбонильных соединений являются своеобразными структурными изомерами. Поскольку эти изомеры легко переходят друг в друга под действием кислот или оснований для такого вида изомерии используется специальный термин таутомерия.
Например:
![]()
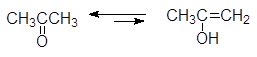 |
(>99%) (1,5x10-4%)
Енольная форма обычных альдегидов и кетонов не была выделена в чистом виде, т.к. она быстро превращается в карбонильную форму.
Для b-дикарбонильных соединений енольная форма может быть выделена в чистом виде, так как у этих соединений енольные формы достаточно стабильны, причем в некоторых случаях они даже более стабильны, чем карбонильные.
![]()
2,4-пентандион (24%) енольная форма (76%)
Cтабильность енольной формы b-дикарбонильных соединений объясняется возникающим сопряжением и образованием внутримолекулярной водородной связи:
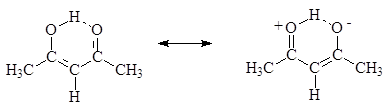
Превращение карбонильных и енольных форм друг в друга является примером таутомерного превращения, понятие о котором мы теперь можем сформулировать в общем виде.
Термин таутомерия обозначает обратимое превращение органических соединений. Чаще всего таутомерия относится к миграции протонов, т.е. перемещению протона от одного атома к другому, при котором, как правило, происходит перемещение двойной связи. В определенном смысле таутомерный сдвиг протонов является внутримолекулярным кислотно-основным превращением. Возникающие при миграции протона изомеры называют таутомерами.
При таутомерных превращениях оптических изомеров они могут превращаться в рацемическую смесь. Например, (R)-втор-бутилфенилкетон при стоянии перестает вращать плоскость поляризованного света.
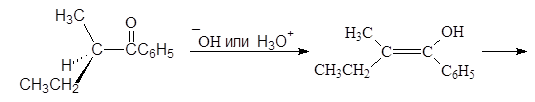 (4)
(4)
(R)-втор-бутилфенилкетон енол
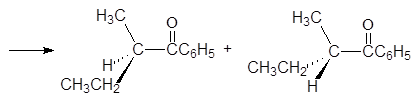
(R)-втор-бутилфенилкетон (S)-втор-бутилфенилкетон
Упр. 1. Напишите формулу 2,4-циклогексадиен-1-она и объясните, почему он существует практически только в енольной форме?
Альдольные реакции
При действии на ацетальдегид разбавленного раствора NaOH при обычной или даже пониженной температуре происходит его димеризация с образованием 3-гидроксибутаналя. Поскольку 3-гидроксибутаналь одновременно является альдегидом и спиртом (алкоголь) его обычно называют “альдоль”, а реакции такого типа стали называть альдольными реакциямиили реакциями альдольного присоединения.
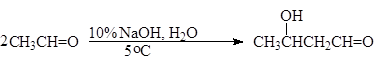 |
(5)
3-гидроксибутаналь (альдоль)
Кетоны также вступают в катализируемое основаниями альдольное присоединение, равновесие не столь благоприятно, как в случае альдегидов. Это препятствие преодолевается проведением реакции в условиях быстрого выведения продукта из реакционной смеси. Из ацетона, например, таким путем может быть получен диацетоновый спирт:
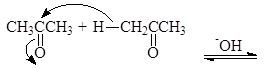 | 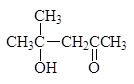 | ||
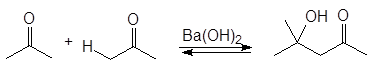
4-гидрокси-4-метил-2-пентанон
Альдольное присоединение проходит по трехстадийному механизму. На первой стадии основание (гидроксид-анион) отрывает протон от a углерода молекулы ацетальдегида давая енолят-ион с делокализованным отрицательным зарядом:
![]() (М 1)
(М 1)
енолят-анион
На второй стадии енолят-анион выступает в роли нуклеофила и атакует карбонильный атом углерода другой молекулы ацетальдегида. На этой стадии образуется алкоксид-анион.
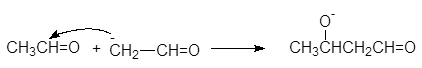
алкоксид-анион
На третьей стадии алкоксид-анион отрывает протон от молекулы воды и превращается в альдоль.
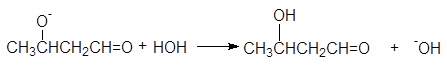
более сильное адьдоль менее сильное основание
В механизме альдольного присоединения проявляются два основных свойства карбонильных соединений: кислотность a водородов и склонность карбонильной группы к реакциям нуклеофильного присоединения.
Если реакционную смесь, образующуюся при альдольном присоединии, нагреть то происходит дегидратация, приводящая к образованию кротонового альдегида (2-бутеналя):
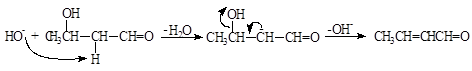 (7)
(7)
кротоновый альдегид
Следует помнить, что подвижными в карбонильных соединениях являются лишь a-атомы водорода.
