Жидкофазное и газофазное гидрирование углеводородов
При прочих равных условиях селективность зависит от времени контакта, определяющего фактическую степень конверсии исходного вещества. Чем ближе она к равновесной, тем значительнее развитие последовательных реакций более глубокого гидрирования. Обычно гидрирование проводят до высокой (до 90%) степени конверсии. Но для каждого процесса время контакта определяется экспериментально.
Все реакции присоединения водорода являются экзотермическими и обратимыми. Теплота гидрирования алкенов с двойной связью на конце молекулы (пропилен, бутен-1) больше, чем алкенов с двойной связью, расположенной ближе к середине цепи (бутен-2).
При расчете на одну молекулу присоединяющегося водорода тепловой эффект наиболее высок для соединений со связью СºС.
СНºСН + 2Н2 ® СН3-СН3 (-DН = 311 кДж/моль)
Для ароматических систем он меньше, чем для олефинов, что может быть обусловлено нарушением устойчивости ароматической системы.
С6Н6 + 3Н2 ® С6Н12 (-DН = 206 кДж/моль)
RCH=CH2 + H2 ® RCH2-CH3 (-DН = 113-134 кДж/моль)
При гидрировании двойной связи между углеродом и кислородом в карбонильных соединениях тепловой эффект ниже, чем для двойной углерод - углеродной связи
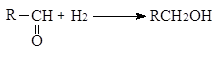 |
(-DН = 67-68 кДж/моль)
при этом гидрирование альдегидов более экзотермично, чем гидрирование кетонов:
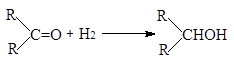 |
(-DН = 67-68 кДж/моль)
Близкий к ним тепловой эффект (в расчете на одну молекулу водорода) имеет гидрирование нитрилов:
RCN + 2H2 ® RCH2NH2 (-DН = 134-159 кДж/моль).
Наименьший тепловой эффект наблюдается при гидрировании кислот:
RCOOH + 2H2 ® RCH2OH + H2O (-DН = 38-42 кДж/моль)
и деструктивном гидрировании связи С-С
-СН2-СН2- + Н2 ® -СН3 + -СН3 (-DН = 42-63 кДж/моль)
Особенности оформления реакционного узла газофазного гидрирования углеводородов. Равновесие реакций гидрирования. Специфика применения катализаторов различного типа при проведении реакций гидрирования. Кинетика реакций гидрирования.
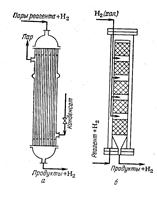
Реакционные аппараты для газофазного гидрирования:
а) трубчатый реактор; б) колонна со сплошными слоями гетерогенного катализатора и охлаждением холодным водородом
Реакция гидрирования обратима. Обратный процесс – дегидрирование. Вследствие экзотермичности реакций гидрирования равновесная степень превращения увеличивается при понижении температуры.
Термодинамически наиболее благоприятно протекает гидрирование ацетиленовых производных, наименее – гидрирование кислот.
Поскольку при гидрировании (за исключением деструктивного) всегда происходит уменьшение объема. Для увеличения равновесной степени превращения, особенно при высокой температуре, применяют повышенное давление. Другим методом повышения степени превращения является применение избытка водорода по сравнению со стехиометрическим от 5010-кратного до 100-кратного и более. Часто одновременно применяется и повышенное давление, и избыток водорода.
Равновесие благоприятно для гидрирования неразветвленных углеводородов с небольшой молекулярной массой, а также для гидрирования низших олефинов, диенов и, как уже говорилось выше, для ацетиленовых углеводородов, причем наличие фенильных заместителей и разветвления углеродной цепи сказывается отрицательно. Менее выгодны условия гидрирования альдегидов, нитрилов, кетонов и ароматических ядер. Если провести сравнение для температуры, при которой Кр = 1, получим следующий ряд способности к гидрированию, учитывающий только термодинамические факторы:
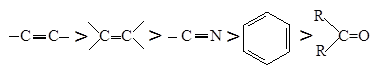 |
В процессах гидрирования, сопровождающихся выделением воды, равновесие обычно смещено вправо в большей мере, чем в других случаях.
Для гидрирования вещества Кр равна А + Н2 ® АН2
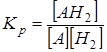 .
.
Для реакций перераспределения водорода А + ВН2 ® АН2 + В
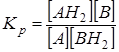
Равновесие реакции перераспределения будет смещено вправо, когда в термодинамическом отношении вещество А более склонно к гидрированию, чем вещество В, например:
3RCH=CH2 + C6H12 ® 3RCH2-CH3 + C6H6
Гидрирование может протекать в гомогенной (газовой или жидкостной), гетерогенной (газ-жидкость, газтвердое тело, жидкостьтвердое тело) системах в присутствии катализаторов или без них.
Скорость реакций гидрирования в общем случае может зависеть от диффузионных и кинетических факторов. Первые из них играют тем меньшую роль, чем интенсивнее перемешивание и чем ниже температура. Скорость гидрирования определяется в большей степени, чем для других процессов, влиянием следующих факторов:
· величиной окислительно-восстановительного потенциала системы;
· скоростью диффузии реагентов из одной фазы в другую;
· скоростями адсорбции, хемосорбции и диффузии в адсорбированный слой;
· ориентацией адсорбированных молекул и т.д.
Процессы гидрирования обычно осуществляются в условиях, когда равновесие реакции значительно смещено вправо и можно пренебречь обратной реакцией дегидрирования. Кроме того, насыщенный продукт гидрирования имеет небольшой адсорбционный коэффициент и поэтому обычно не входит в кинетическое уравнение процесса. И, наоборот, при высоком давлении становится существенной сорбция не только исходного вещества, но и водорода.
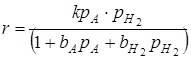 ,
,
где Р – парциальные давления реагентов;
b – адсорбционные коэффициенты реагентов.
С такими катализаторами, как платина, палладий, никель, энергично сорбирующими водород, скорость реакции при умеренных температурах (100оС) не зависит от парциального давления водорода. Оно начинает влиять на скорость только при повышении температуры - вначале незначительно, а затем пропорционально возрастанию давления. Наблюдается и отчетливое самоторможение реакции исходными ненасыщенными соединениями. Как уже говорилось, на оксидных катализаторах сорбция водорода менее значительна, чем на металлах, вследствие чего скорость обычно зависит от парциального давления водорода линейно. Этим обусловлена большая эффективность применения высоких давлений и избытка водорода при гидрировании на оксидных катализаторах.
В жидкофазных процессах высокое давление оказывает дополнительное влияние, повышая растворимость водорода в реакционной массе. Возможна линейная, квадратичная и даже более сильная зависимость скорости реакции от давления. Так, при гидрировании этиллаурата в лауриловый спирт на медь – хромоксидном катализаторе скорость возрастает в 7 раз при повышении давления от 10 до 20 МПа, а с увеличением до 30 Мпа – в 28 раз.
