Изобарно-изотермический потенциал
Определить изменение изобарно-изотермического потенциала реакции N2(г) + 2Н2О(ж) = NH4NO2 (ж) и дать заключение о направлении ее протекания при стандартных условиях, если ![]() для Н2О(ж) равна – 237,4 кДж/моль, а для NH4NO2(ж) равна – 115,8 кДж/моль.
для Н2О(ж) равна – 237,4 кДж/моль, а для NH4NO2(ж) равна – 115,8 кДж/моль.
Решение.
Изобарно-изотермический потенциал реакции рассчитывается так же, как и тепловой эффект реакции – по стандартным теплотам образования веществ:
![]()
![]()
![]() Следовательно, реакция может идти в обратном направлении.
Следовательно, реакция может идти в обратном направлении.
17. При температуре 298 К реакция заканчивается через 2,5 ч. Рассчитать, при какой температуре она закончится через 20 мин., если температурный коэффициент реакции равен 3.
Решение.
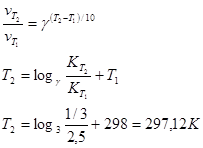
Ответ: 297 К.
25. Уравнение изотермы химической реакции Вант-Гоффа.
В соответствии с законом действующих масс для произвольной реакции
а A + b B = c C + d D
уравнение скорости прямой реакции можно записать:
![]() ,
,
а для скорости обратной реакции: ![]() .
.
По мере протекания реакции слева направо концентрации веществ А и В будут уменьшаться и скорость прямой реакции будет падать. С другой стороны, по мере накопления продуктов реакции C и D скорость реакции справа налево будет расти. Наступает момент, когда скорости υ 1 и υ 2 становятся одинаковыми, концентрации всех веществ остаются неизменными, следовательно,
![]() ,
,
Откуда Kc = k1 / k2 = ![]() .
.
Постоянная величина Кс, равная отношению констант скоростей прямой и обратной реакций, количественно описывает состояние равновесия через равновесные концентрации исходных веществ и продуктов их взаимодействия (в степени их стехиометрических коэффициентов) и называется константой равновесия. Константа равновесия является постоянной только для данной температуры, т.е.
Кс = f (Т). Константу равновесия химической реакции принято выражать отношением, в числителе которого стоит произведение равновесных молярных концентраций продуктов реакции, а в знаменателе – произведение концентраций исходных веществ.
Если компоненты реакции представляют собой смесь идеальных газов, то константа равновесия (Кр) выражается через парциальные давления компонентов:
Kp = ![]() .
.
Для перехода от Кр к Кс воспользуемся уравнением состояния P · V = n·R·T. Поскольку
![]() , то P = C·R·T.
, то P = C·R·T.
Тогда ![]() .
.
Из уравнения следует, что Кр = Кс при условии, если реакция идет без изменения числа моль в газовой фазе, т.е. когда (с + d) = (a + b).
Если реакция (1.33) протекает самопроизвольно при постоянных Р и Т или V и Т, то значения G и F этой реакции можно получить из уравнений:
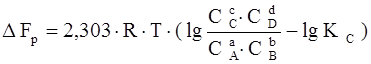 ,
,
где С А, С В, С С, С D – неравновесные концентрации исходных веществ и продуктов реакции.
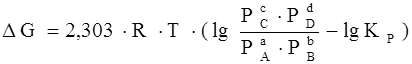 ,
,
где Р А, Р В, Р С, Р D – парциальные давления исходных веществ и продуктов реакции.
Два последних уравнения называются уравнениями изотермы химической реакции Вант-Гоффа. Это соотношение позволяет рассчитать значения G и F реакции, определить ее направление при различных концентрациях исходных веществ.
Необходимо отметить, что как для газовых систем, так и для растворов, при участии в реакции твердых тел (т.е. для гетерогенных систем) концентрация твердой фазы не входит в выражение для константы равновесия, поскольку эта концентрация практически постоянна. Так, для реакции
2 СО (г) = СО 2 (г) + С (т)
константа равновесия записывается в виде
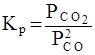 .
.
Зависимость константы равновесия от температуры (для температуры Т2 относительно температуры Т1) выражается следующим уравнением Вант-Гоффа:
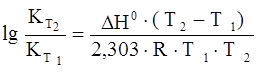 ,
,
где Н0 – тепловой эффект реакции.
Для эндотермической реакции (реакция идет с поглощением тепла) константа равновесия увеличивается с повышением температуры, система как бы сопротивляется нагреванию.
33. Эбулиоскопическая константа воды равна 0,512. Рассчитать, при какой температуре кипит 5 %-ный раствор сахарозы в воде.
Решение.
Повышение температуры кипения раствора
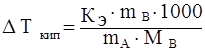
![]() г/моль
г/моль
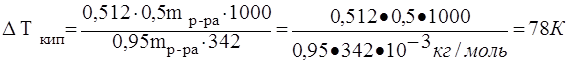
Температура кипения Т = То +Ткип=373 К+78К=451К
59. Свойства дисперсных систем и растворов ВМС, их сходство и отличие. Пояснить, какими путями можно перейти от истинного раствора ВМС к дисперсной системе.
Основными отличительными особенностями дисперсных систем являются:
а) способность к рассеиванию ими света;
б) медленная диффузия частиц дисперсной фазы в дисперсионной среде;
в) способность к диализу;
г) агрегативная неустойчивость дисперсной фазы, которая определяется выделением частиц из дисперсионной среды при добавлении к системе электролитов или под влиянием других внешних воздействий.
Понятие агрегатного состояния не применимо к ВМС, применяется понятие фазового (в структурном смысле) состояния. По сути, понятие фазового состояния характеризует порядок взаимного расположения молекул: ВМС могут находиться в кристаллическом, аморфном и, чрезвычайно редко, в газообразном фазовом состояниях, причем наиболее типичным является аморфное состояние. Последнее дополнительно подразделяется на стеклообразное, высокоэластическое и вязкотекучее. Переход из одного состояния в другое всегда протекает не резко, а в некотором интервале температур.
При помещении ВМС в растворитель происходит поглощение растворителя и соответствующее увеличение объема и массы полимера, идет процесс набухания.
Если каким-либо способом воспрепятствовать увеличению объема ВМС при его набухании, то со стороны ВМС может проявляться чрезвычайно высокое давление набухания, достигающее нескольких атмосфер (пример – дробление скал древесными клиньями, заливаемыми водой).
Процесс набухания высокомолекулярного вещества связан с взаимодействием макромолекул с молекулами растворителя, и степень набухания ВМС зависит как от природы ВМС, так и от природы растворителя. Набухание полярного ВМС протекает только в полярном растворителе, а неполярного – только в неполярном (полезно вспомнить эмпирическое правило: подобное растворяется в подобном).
