Изучение кето-енольной таутомерии на примере АУЭ
Возможности применения АУЭ в синтезах разнообразных продуктов расширяются благодаря его способности подвергаться расщеплению в двух направлениях. При нагревании с разбавленными растворами щелочей или кислот происходит распад образующейся после гидролиза ацетоуксусной кислоты с образованием кетонов. Обработка концентрированными растворами щелочей приводит к образованию из АУЭ двух молекул уксусной кислоты (кислотное расщепление):
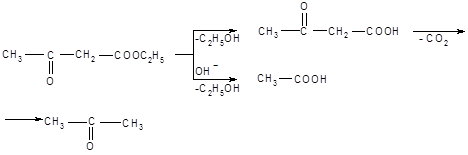
Механизм кислотного расщепления состоит в нуклеофильной атаке гидроксил-ионом карбонильного углерода, несущего частичный положительный заряд. После присоединения гидроксида неустойчивый продукт распадается:
Пример синтеза с использованием АУЭ:
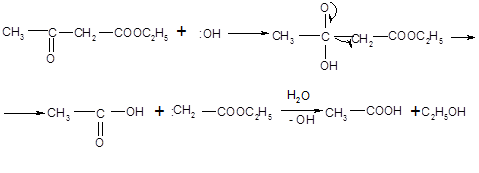
2. Экспериментальная часть
Опыт 1. Кислотные свойства ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир………….5 мл Цилиндр (100 мл)……… 1
Едкий натр (2% раствор)……100 мл Капельная воронка………1
Соляная кислота (10%)……….50 мл
Выполнение опыта
В цилиндр с ацетоуксусным эфиром приливают из капельной воронки разбавленную щелочь, пока не получится прозрачный раствор. При прибавлении соляной кислоты до кислой реакции (на бумажку конго) вновь выделяется ацетоуксусный эфир в виде маслянистого слоя.
Опыт 2. Получение натриевого производного ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир (свеже – Колба (500 мл)………….1
перегнанный) ………………100 мл Холодильник……………1
Натрий металлический (в керосине Водяная баня……………1
или лигроине) ………………… 7 г Банка (50 мл)……………1
Фильтровальная бумага
Выполнение опыта
В колбу с обратным холодильником вводят ацетоуксусный эфир и бросают через холодильник мелконарезанные пластинки натрия, очищенные от корочки и обтертые от керосина. После того как весь натрий прореагирует, колбу с реакционной смесью охлаждают в бане с ледяной водой; при этом выпадает в осадок натриевое производное ацетоуксусного эфира. Так как натрий иногда не успевает в течении лекции раствориться полностью, осаждение натриевого производного можно показать на следующей лекции.
Опыт 3. Взаимодействие ацетоуксусного эфира с хлорным железом.
Реактивы и посуда
Ацетоуксусный эфир……….2 мл Цилиндр (200 мл)………1
Этиловый спирт (50%)….…50 мл
Хлорное железо (2%
раствор)……………….10 мл
Выполнение опыта
В цилиндре смешивают ацетоуксусный эфир со спиртом и приливают хлорное железо; появляется сине-фиолетовое окрашивание, характерное для енольной формы ацетоуксусного эфира.
Опыт 4. Взаимодействие ацетоуксусного эфира с уксуснокислой медью.
Реактивы и посуда
Ацетоуксусный эфир…….10 мл Цилиндр с притертой пробкой
Этиловый спирт………… 10 мл (50 мл)….………………………1
Уксусная медь (насыщенный
раствор)………………….10 мл
Аммиак (конц. раствор)… 3–5 мл
Выполнение опыта
В цилиндре смешивают ацетоуксусный эфир, спирт и уксуснокислую медь. При энергичном взбалтывании прибавляют несколько капель аммиака. Вскоре образуется кристаллическая масса, окрашенная в светло-зеленый цвет, – медное производное ацетоуксусного эфира.
Опыт 5. Кетонное расщепление ацетоуксусного эфира.
Реактивы, посуда и приборы
Ацетоуксусный эфир………10 мл Круглодонная колба (100 мл)… 1
Серная кислота (10%)…… 20 мл Промывная склянка Тищенко….1
Баритовая вода…………… 30 мл Стеклянные и резиновые трубки
Соответствующих размеров
Сборка прибора
Колбу соединяют с обратным холодильником, верхний конец которого закрывают пробкой с изогнутой вниз трубкой; последнюю соединяют с промывной склянкой, в которую налита баритовая вода.
Выполнение опыта
В колбу наливают ацетоуксусный эфир и серную кислоту. Реакционную смесь нагревают до кипения. При этом происходит разложение эфира с образованием ацетона и углекислого газа; последний с баритовой водой образует осадок углекислого газа.
Опыт 6. Таутомерия ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир… 5 мл Цилиндр (200 мл)………………… 1
Хлорное железо (2% раст – Капельные воронки……………… 2
вор)……………………25 мл
Бромная вода………….25 мл
Выполнение опыта
В цилиндре растворяют ацетоуксусный эфир в 100 мл воды и приливают из капельной воронки несколько миллилитров хлорного железа; через некоторое время появляется сине-фиолетовая окраска комплексной железной соли енольной формы. При прибавлении из второй капельной воронки бромной воды бром присоединяется к енольной форме и раствор обесцвечивается. Через несколько секунд окраска появляется снова, так как равновесие смещается и вновь появляется енольная форма; при дальнейшем прибавлении бромной воды окраска исчезает.
Опыт 7. Титрование енольной формы ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир… 5 мл Капельные воронки ………………2
В-нафтол х.ч. (10% спир – Бюксы (маленькие)……………… 3
товой раствор)………30 мл Конические колбы широкогорлые
Йодистый калий (5% (250 мл)………………………… 3
раствор) …………….30 мл Бюретки……………………………2
Этиловый спирт…… 250 мл Склянка с притертой пробкой
Тиосульфат натрия (100 мл)………………………… 1
(0,1 н. раствор)…….150 мл Чашки фарфоровые ……………….2
Бром………………… 25 мл Водяная баня………………………1
Выполнение опыта
До лекции берут три навески ацетоуксусного эфира (приблизительно по 1.5.г). Спиртовой раствор β-нафтола, йодистый калий и спирт охлаждают в бане со льдом.
Приготовляют спиртовой раствор брома, для чего в склянку с притертой пробкой вливают 50 мл охлажденного спирта и приливают из капельной воронки бром до появления светло-красной окраски.
На лекции осторожно вносят бюкс с навеской ацетоуксусного эфира в коническую колбу, приливают 25 мл охлажденного спирта и колбу встряхивают до растворения эфира. К полученному раствору быстро прибавляют при взбалтывании спиртовой раствор брома до появления светло-красной окраски, после чего приливают спиртовой раствор β-нафтола до полного обесцвечивания. Затем из капельной воронки при охлаждении прибавляют раствор йодистого калия так, чтобы появился бурый цвет йода, и титруют тиосульфатом до исчезновения окраски йода.
Выводы
1. АУЭ относится к β-дикарбонильным соединениям;
2. Изучены особые свойства АУЭ. Разработан демонстрационный опыт по кето-енольной таутомерии АУЭ
3. Разработан видеофрагмент «Кето-енольная таутомерия АУЭ»
Библиографический список
1. Темникова Т.И., Курс теоретических основ органической химии, Ленинград, ВШ, 1968 г. с. 484–495
2. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для вузов – М.: Высшая школа, 1981 г. с. 261–265
3. Иванов В.Г. Органическая химия: Учеб. Пособие для студ. высш. пед. учеб. Заведений – М.: Издательский центр «Академия», 2005 г. с. 269–275
4. Зонис С.А., Мазуров С.М., Лекционные опыты и демонстрационные материалы по органической химии. – Ленинград: Ленгосхимиздат, 1966, с. 253–256
