Исследование кинетики реакции хлорирования бензола
|
№опыта |
9 |
|
Т, мин |
Ln(C01/C1) |
|
4 |
0,0122413 |
|
8 |
0,0239512 |
|
12 |
0,0345914 |
|
16 |
0,0483153 |
|
20 |
0,0616981 |
|
24 |
0,0723915 |
|
32 |
0,0955936 |
|
40 |
0,1184082 |
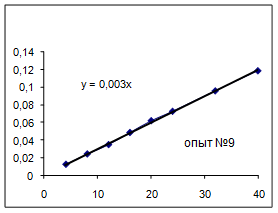
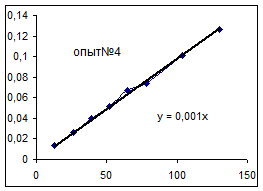
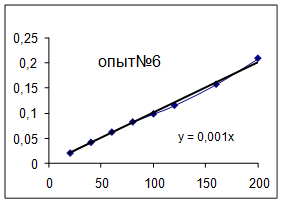
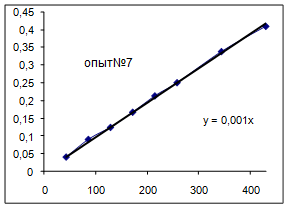
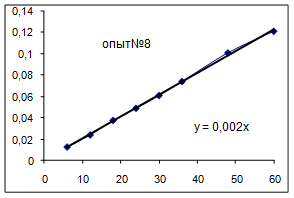
Как видно из уравнений прямых на диаграммах, значение Кнабл для всех опытов, кроме последних двух, одинаково и равно 0,001. Значит, в последних двух опытах действует какой-то другой параметр системы. Причем явно видно, что от концентрации хлора Кнабл совсем не зависит, т. к. для всех первых 7 опытов значение константы одинаково, но значение начальной концентрации хлора разное.
Если предположить, что в кинетическом уравнении вместо [A2] стоит суммарная концентрация катализатора, то тенденция в изменении Кнабл выглядит закономерной:
|
Кнабл |
Ск |
|
0,001 |
0,1 |
|
0,002 |
0,2 |
|
0,003 |
0,3 |
Определение значения константы скорости методом наименьших квадратов
Метод заключается в следующем:
R = k•C1•Ck∑
можно представить в виде уравнения прямой: у = Вх, где y=R, B=k, x=C1•Ck∑.
Домножая правую и левую часть уравнения у = Вх на х, получим квадратичное уравнение ух = Вх2.
Значение константы вычислим как: В = ух / х2.
№опыта
|
1 |
2 |
3 |
5 |
4 |
6 |
7 |
8 |
9 | ||||||||
|
R |
R |
R |
R |
R |
R |
R |
R |
R | ||||||||
|
0,0056 |
0,0056 |
0,0056 |
0,0056 |
0,0051 |
0,0036 |
0,0015 |
0,0115 |
0,0167 | ||||||||
|
С1•Сk |
С1•Сk |
С1•Сk |
С1•Сk |
С1•Сk |
С1•Сk |
С1•Сk |
С1•Сk |
С1•Сk | ||||||||
|
0,5925 |
0,5927 |
0,5928 |
0,5931 |
0,5921 |
0,392 |
0, 192 |
1,1854 |
1,7781 | ||||||||
|
(С1•Сk) 2 |
(С1•Сk) 2 |
(С1•Сk) 2 |
(С1•Сk) 2 |
(С1•Сk) 2 |
(С1•Сk) 2 |
(С1•Сk) 2 |
(С1•Сk) 2 |
(С1•Сk) 2 | ||||||||
|
0,351056 |
0,351293 |
0,351412 |
0,351768 |
0,350582 |
0,153664 |
0,036864 |
1,405173 |
3,16164 | ||||||||
|
R•C1•Ck |
R•C1•Ck |
R•C1•Ck |
R•C1•Ck |
R•C1•Ck |
R•C1•Ck |
R•C1•Ck |
R•C1•Ck |
R•C1•Ck | ||||||||
|
0,003318 |
0,003319 |
0,00332 |
0,003321 |
0,00302 |
0,001411 |
0,000288 |
0,013632 |
0,029694 | ||||||||
|
B=YX/X2 |
B=YX/X2 |
B=YX/X2 |
B=YX/X2 |
B=YX/X2 |
B=YX/X2 |
B=YX/X2 |
B=YX/X2 |
B=YX/X2 | ||||||||
|
0,009451 |
0,009448 |
0,009447 |
0,009442 |
0,008613 |
0,009184 |
0,007813 |
0,009701 |
0,009392 | ||||||||
|
Bсред= k = |
0,00917 | |||||||||||||||
