Карбоновые кислоты и их производные
Карбоновыми кислотами называют органические соединения, содержащие в своем составе карбоксильную группу. По международной заместительной номенклатуре карбоновым кислотам соответствует окончание -овая кислота в названии.
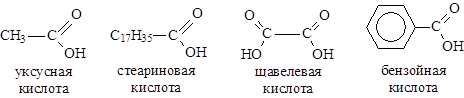 |
кислот (см. тему "Жиры"), приняты тривиальные названия (уксусная, стеариновая).
По числу карбоксильных групп делятся на монокарбоновые (одноосновные) и дикарбоновые (двухосновные), в зависимости от строения углеводородного скелета - на алифатические (уксусная, щавелевая) и ароматические (бензойная).
Предельные одноосновные карбоновые кислоты, содержащие от одного до одиннадцати атомов углерода - жидкости, хорошо смешивающиеся с водой. В твердом и жидком состояниях, а также в водных растворах молекулы кислот димеризуются в результате образования между ними водородных связей.
Одноосновные карбоновые кислоты
Общие способы получения
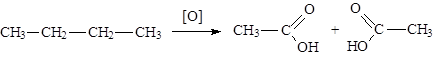 |
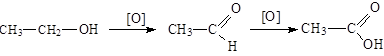 |
Оксосинтез (см. тему «Химические свойства алкенов»).
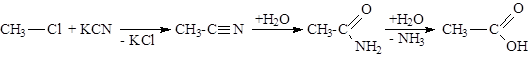 |
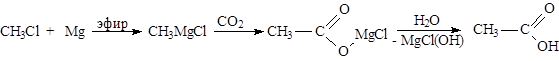 |
Гидролиз сложных эфиров - см. тему «Химические свойства одноатомных спиртов».
Химические свойства
Взаимное влияние составляющих карбоксильную группу карбонила и гидроксила с одной стороны уменьшает поляризацию связей С=O карбонила, с другой стороны ослабляет связь О-Н гидроксила, что приводит к отсутствию реакций нуклеофильного присоединения AN и увеличению подвижности водорода гидроксила (кислотные свойства).
Кислотные свойства.
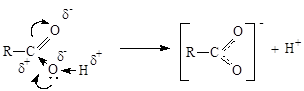 Карбоновые кислоты - слабые кислоты. С увеличением углеводородного радикала степень диссоциации уменьшается. Предельные монокарбоновые кислбты обладают всеми свойствами обычных кислот:
Карбоновые кислоты - слабые кислоты. С увеличением углеводородного радикала степень диссоциации уменьшается. Предельные монокарбоновые кислбты обладают всеми свойствами обычных кислот:
a) 2RCOOH + Mg ¾® (RCOO)2Mg + Н2;
б) 2RCOOH + СаО ¾® (RCOO)2Ca + Н2О ;
в) RCOOH + КОН ¾® RCOOK + Н2О;
г) 2RCOOH + Na2CO3 ¾® 2RCOONa + СO2 + Н2О.
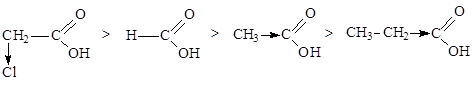 |
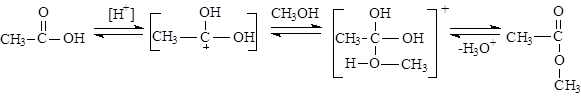 |
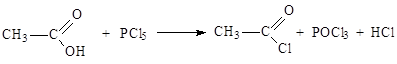 |
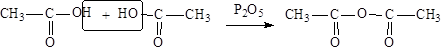 |
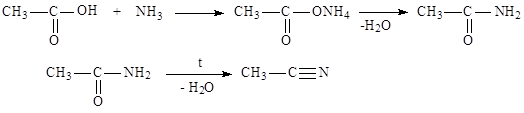 |
Непредельные карбоновые кислоты
Способы получения
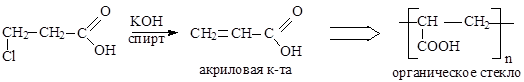 |
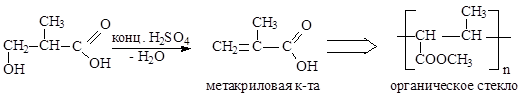 |
Нитрильный синтез:
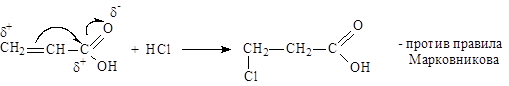 |
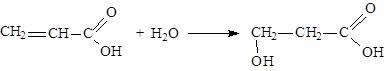 |
Двухосновные кислоты
Химические свойства
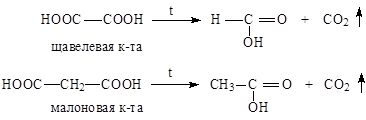 |
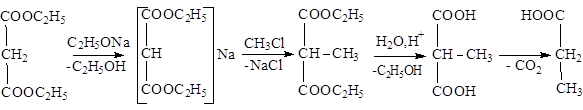 |
Двухосновные непредельные кислоты
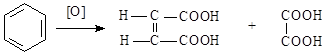 |
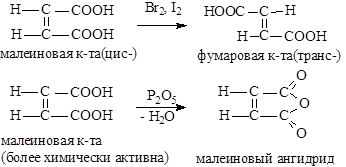 |
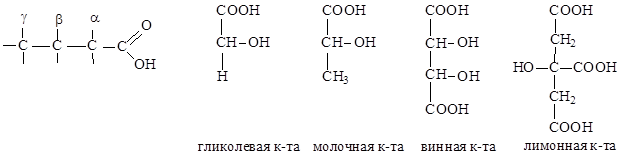 |
Способы получения
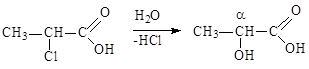 |
