Кислотно-каталитические процессы в нефтепереработке и в нефтехимии. Решение обратной задачи кинетики статистическими методами
Различные функции падения активности по времени обобщены в теории, учитывающей, как важный фактор, время проведения процесса и предполагающей параллельное протекание различных процессов, ведущих к отравлению катализатора, т.е. к уменьшению количества активных центров CS. Уравнение (1) не включает концентраций реагентов и ядов и является, таким образом, эмпирическим уравнением, но оно было успешно применено для большого числа реакций крекинга и дегидрирования
![]() (1)
(1)
Если обозначить долю центров, сохранивших активность, Q = CS/CS0, получим
![]() (2)
(2)
Используют и более простую модель
![]() (3)
(3)
Интегрируя (3), получаем (m ¹ 1)
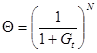 , (4)
, (4)
где G = (m – 1)·Kd·t, N = 1/(m – 1).
Если активность катализатора пропорциональна числу активных центров Q
![]() , (5)
, (5)
подставив уравнение (4) в уравнение (5), получим зависимость степени превращения XA сырья А как функцию концентраций, температуры и характера дезактивации активных центров.
Рассмотрим подробнее реакции скелетной изомеризации парафинов и нафтенов.
Скелетная изомеризация парафинов
Устойчивость ионов карбения растет в ряду R+перв < R+втор < R+трет. Поэтому процессы скелетной изомеризации парафинов термодинамически выгодны. Например, реакция (6) экзотермична
![]()
![]() кДж/моль (6)
кДж/моль (6)
и при 25оС в равновесии отношение концентраций tBu+ / 2 – Bu+ @ 1010. Простейший механизм скелетной изомеризации парафинов включает 1,2-перенос метильных (алкильных) групп в первичном R+. Образование первичного R+ происходит различными путями. Главные пути – протонизация олефинов и отрыв H– подходящим акцептором (апротонным центром, ионом металла, другим ионом R+, появившимся в системе из олефинов)
![]()
1,2-Перенос алкильной группы сопровождается 1,2-гидридным сдвигом в направлении образования более устойчивого иона R+.
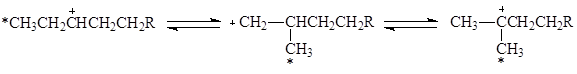
Вместе с тем, 1,2-перенос алкильной группы не объясняет факты, установленные при изучении изомеризации меченого 13С бутана. Обнаружены два изомера и две пары изотопомеров:
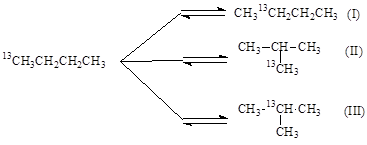
Образование изомеров I и III нельзя объяснить 1,2-переносом CH3-группы. Механизм этих реакций объясняют с позиций образования ионов карбония. При 1,2-сдвиге метильной группы в первичном ионе карбения образуется ион карбония (IV), который можно рассматривать как продукт протонирования циклопропанового кольца (V):
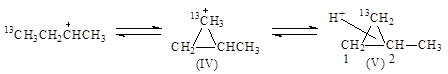
При разрыве С1-С2-связи образуются ионы карбения СH313CH2+CHCH3 и +CH213CH2CH2CH3, которые приводят к продуктам I и III
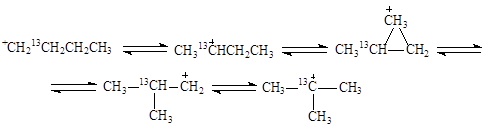
Относительные скорости взаимных превращений углеводородов в процессе скелетной изомеризации отражают более быстрое изменение положения третичного атома, чем превращения вторичного в третичный:
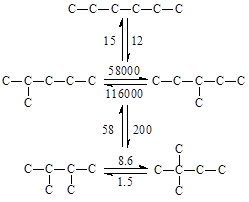
В реакциях крекинга парафинов основными продуктами являются низшие парафины, тогда как олефины (особенно С4 и С5) образуют полимеры, ароматические соединения и кокс. В процессе крекинга гексадекана обнаружено 60 углеводородов от С1 до С10. Условия крекинга и природа катализатора (сила кислотных центров, соотношение протонных и апротонных центров) влияет на состав продуктов.
В процессе крекинга циклопарафинов (нафтенов) образуются алифатические углеводороды и циклы меньшего размера, при этом на алюмосиликатных катализаторах обнаружено даже заметное дегидрирование циклопарафинов. Механизм дегидрирования пока-что не установлен. Механизм изомеризации циклов представляют следующей цепочкой превращений ионов карбения и карбония (или неклассических ионов карбения):
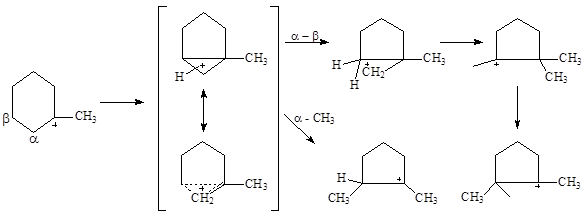
Реакции алкилирования
Реакции алкилирования – процессы обратные крекингу – занимают важное место в нефтехимии и в органическом синтезе. Реакции алкилирования используют для получения ценных компонентов моторных топлив, повышающих их октановые числа. Для получения алкилатов используют реакции алкилирования парафинов олефинами. Так, изобутан алкилируют изобутиленом и смесью изомерных бутиленов, а также пропиленом. Реакцию проводят в двухфазной системе – концентрированная H2SO4 (90 – 97%) - углеводороды в присутствии ПАВ (R4N+X–, цетиламин, октиламин). Процесс является цепным и включает следующие типичные для кислотного катализа стадии. В концентрированных кислотах сольватация карбкатиона осуществляется молекулой кислоты
![]() (7)
(7)
Сольватированный tBu+ взаимодействует со второй молекулой олефина с образованием димерного карбкатиона. Для упрощения изобразим схему реакций с участием свободных R+:
![]() (8)
(8)
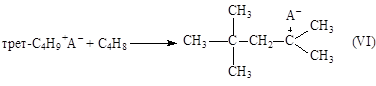 (9)
(9)
Карбкатион (VI) C8H17+ взаимодействует с изо-C4H10, отрывает от него Н– и превращается в изооктан C8H18 (целевой продукт реакции). Нежелательный процесс – дальнейшее присоединение олефина с последующей полимеризацией.
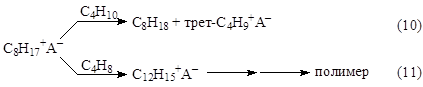
Поверхностно-активные вещества заметно увеличивают скорость реакции (10), тем самым повышая октановые числа алкилатов. Катионоподобные ПАВ повышают реакционную способность R+, уменьшают его стабилизацию кислотной фазой и делают отрыв H– от RH более эффективным.
Процессы алкилирования катализируются и другими кислотами (CF3SO3H, HF). В системе углеводород-HF-1%H2O процесс алкилирования протекает эффективнее и селективнее. Октановые числа алкилатов достигают 92 – 95. Предложен интересный механизм алкилирования изобутана пропиленом в присутствии HF.
![]()
![]()
![]()
![]()
![]()
Брутто-реакция представляет собой дегидродимеризацию изобутана с переносом 2 атомов водорода на пропилен:
![]() (12)
(12)
С целью заменить процессы с жидкими кислотами исследуют возможность использования цеолитов для алкилирования парафинов олефинами. Показано, что в этом случае в процесс алкилирования вступает этилен. На Na-X цеолитах при замене части Na+ ионами РЗЭ получаются достаточно высокие выходы алкилатов (80 – 100оС, Р = 2 МПа).
