Классы неорганических веществ. Растворы электролитов. Размеры атомов и водородная связь
Рис. 1. Полярографический электрохимический детектор кислорода.
Например, в кислородном амперометрическом сенсоре (рис. 1) внутри цилиндрического корпуса 1 расположены индикаторный электрод 2 из платины и анод 3 из хлорида серебра (он же электрод сравнения). Электролит (водный раствор КС1) заливается в резервуар 4 и образует пленку 5 толщиной около 10 мкм. Полимерная мембрана 6 (полиэтилен, полипропилен, фторопласт, целлофан и др.) отделяет электролит от анализируемой среды (вода, газ), из которой кислород диффундирует через мембрану внутрь элемента и восстанавливается на катодно-поляризованном индикаторном электроде (реакция О2 + 4е- + 4Н+ = 2H2O). Ток восстановления определяется скоростью диффузии О2 сквозь мембрану. Скорость, в свою очередь, зависит от толщины и проницаемости мембраны. Катодная поляризация индикаторного электрода осуществляется как от постороннего источника тока, так и с помощью растворимого анода (гальванические сенсоры). Информативным параметром является предельный диффузионный ток при постоянном потенциале индикаторного электрода. Такие электрохимические сенсоры имеют, как правило, линейную зависимость электрического сигнала от парциального давления О2 (или др. электроактивного газа), что обеспечивает более высокую точность определения по сравнению, например, с потенциометрическим электрохимическим сенсором, в котором информативный параметр - равновесный (или квазиравновесный) электродный потенциал - имеет логарифмическую зависимость от содержания газа. Селективность электрохимических сенсоров определяется выбором подходящего материала электрода и рабочей области потенциалов. При анализе смеси газов необходимо, чтобы электрохимические реакции посторонних компонентов либо не имели места на данном электроде, либо протекали в области более высоких потенциалов.
Электрохимические сенсоры позволяют проводить анализ газообразных и жидких сред, в т. ч. суспензий, на содержание О2, О3, Н2, С12, H2S, оксидов N, С, S, причем без всякой пробоподготовки. Возможно определение концентраций, как больших (в случае выбросов, утечек загрязняющих газов и т. д.), так и малых - при контроле ПДК. Основные эксплуатационные характеристики электрохимических сенсоров: диапазон концентраций, чувствительность, селективность, быстродействие (время установления 90%-ного уровня сигнала), ресурс работы, отношение сигнал/шум. Диапазон концентраций Н2 и O2 составляет от 0 до 100% по объему, С12, SO2, H2S, CO - от 0,2 до 200 мг/м3 при быстродействии от 1 до 30 с. Отдельно выделяют электрохимические сенсоры для анализа биологических сред (биосенсоры). На индикаторном электроде биосенсоров закрепляется мембрана из целлофана с иммобилизованным ферментом (глюкозооксидаза, тирозиназа, фенолоксидаза, лакказа и др.). Определяют вещества, которые изменяют скорость ферментативных реакций: субстраты, ингибиторы, сами ферменты. Биосенсоры позволяют с высокой селективностью проводить автоматизированный анализ многокомпонентных систем на глюкозу, холестерин, мочевину, мочевую кислоту, аминокислоты и др. вещества, содержание которых варьирует от 0,05 мкг/мл до 1 мг/мл. Налажен промышленный выпуск электрохимических сенсоров для контроля содержания глюкозы в крови.
Перспективна разработка иммуноэлектрохимических сенсоров, в которых электрический сигнал преобразуется специфическим взаимодействием антиген - антитело.
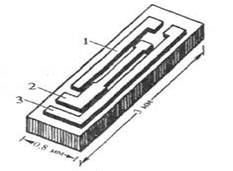
Рис. 2. Схема электрохимического сенсора, изготовленного методом фотолитографии.
Перспективным для серийного производства электрохимических сенсоров считается формирование электродного узла чувствительного элемента с использованием микроэлектронных технологий. На рис. 2 показан единичный чип, полученный методом фотолитографии. На кремниевой пластине длиной 3 мм, шириной 0,8 мм и толщиной 0,38 мм размещена трехэлектродная электрохимическая система: индикаторный электрод из Pt (1), вспомогательный электрод из Pt (2) и хлорсеребряный электрод сравнения (3).
7. Литература
1. Богдановская В. А. [и др.], в кн.: Итоги науки и техники, сер. Электрохимия, т. 31, М., 1990
2. Измайлов Н. А., Электрохимия растворов, 3 изд., М., 1976.
3. Общая и неорганическая химия. Т.1. Теоретические основы химии: Учебник для вузов в 2 томах. Под ред. А.Ф. Воробьева. – М.: ИКЦ "Академкнига", 2004. – 371 с.: ил.
4. Тарасевич М. Р. [и др.], в кн.: Итоги науки и техники, сер. Электрохимия, т. 35, М., 1992.
5. Цивадзе А.Ю., Воробьев А.Ф., Савинкина Е.В. и др. Неорганическая химия. 1 и 2 часть. - М., "Наука", 2004.
