Количественный анализ
Fe2+ - ē ® Fe3+
и, следовательно, величина предельного тока будет зависеть от концентрации в растворе соли Fe2+ .
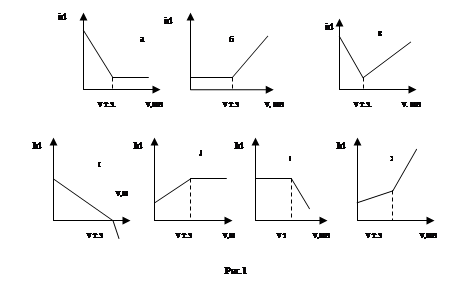
2. Электрохимически активен только титрант (реагент), т.е. он окисляется или восстанавливается на электроде: например, титрование солей Zn2+, Cd2+, Mn2+, Pb2+, Cu2+ ферроцианидом при значении потенциала платинового вращающегося электрода, равном +0,8 В (рис.1б). В этом случае на электроде протекает реакция окисления ферроцианид-ионов, предельный ток пропорционален концентрации ферроцианида в растворе.
3. Восстанавливаются или окисляются на электроде два вещества - определяемое соединение и титрант. Например, титрование солей Cu2+, Cd2+, Zn2+ ортооксихинолином при значении потенциала ртутного капающего электрода равном -1,6 В (рис.1в). В этом случае на электроде до момента эквивалентности восстанавливаются ионы Cu2+, Cd2+, Zn2+, а ортооксихинолин - после момента эквивалентности. Т.о., в этом случае величина предельного тока будет прямо пропорциональна концентрации определяемых ионов Cu2+, Cd2+, Zn2+ в растворе - до точки эквивалентности - и концентрации в растворе ортооксихинолина - после точки эквивалентности.
4. Электрохимически активны как определяемое вещество, так и титрант, причем одно восстанавливается на электроде, другое - окисляется. Например, титрование соли Fe3+ раствором TiCl3 при значении потенциала ртутного электрода, равном -0,25В. Точка эквивалентности обнаруживается вследствие различия угла наклона прямых id - v мл реагента, описывающих изменение тока до и после момента эквивалентности; это связано, с различным числом электронов, принимающих участие в электродных реакциях определяемого вещества и титранта, а также с различием в коэффициентах диффузии этих веществ (рис.1г). В приведенном примере до момента эквивалентности на электроде восстанавливаются ионы Fe3+, величина предельного тока пропорциональна концентрации соли Fe3+ в растворе. После момента эквивалентности на электроде протекает процесс окисления соли титана (III), величина предельного тока пропорциональна концентрации последней в растворе.
5. Электрохимически активен только продукт химической реакции, т.е. на электроде протекает восстановление или окисление образующегося в результате химической реакции соединения (рис.1д). Пример: титрование соединений пятивалентного мышьяка иодидами в кислой среде: в результате химической реакции образуется йод, который восстанавливается на вращающемся платиновом электроде. Предельный ток в этом случае прямо пропорционален концентрации йода, образующегося в растворе.
6. Реагирующие вещества и продукты реакции электрохимически неактивны. Тогда специально в раствор вводится электрохимически активное вещество - «полярографический индикатор». Пример: титрование с «полярографическим индикатором» - солью Fe3+, вводимым перед титрованием соединений алюминия, магния или циркония, раствором фторида; электрод - вращающийся платиновый, значение потенциала равно 0,0 В и отвечает предельному току восстановления активированных ионов Fe3+. В этом случае до точки эквивалентности происходит взаимодействие ионов фтора с определяемым веществом с образованием прочных соединений; только после точки эквивалентности ионы фтора смогут взаимодействовать с Fe3+ (полярографическим индикатором), поскольку образующийся фторидный комплекс менее устойчив. В результате падения концентрации ионов Fe3+ после точки эквивалентности величина предельного тока начинает убывать (рис.1е).
Последний вид титрования основан на использовании различной прочности соединений: определяемое вещество - титрант, «полярографический индикатор» - титрант, образующихся в процессе титрования.
Можно использовать Fe(II) в качестве «полярографического индикатора» при амперометрических титрованиях с ЭДТА. При потенциале +0,4В на платиновом электроде окисляется не Fe(II), а хелат железа (II) с ЭДТА, и, т.о., после достижения точки эквивалентности предельный ток растет. Вид кривой титрования соответствует случаю, изображенному на рис.1 б). Резкий подъем тока наблюдается при рН 4 для большинства ионов металлов, образующих с ЭДТА хелаты, константы, устойчивости которых больше, чем 1018.
В отдельных, редких случаях можно проводить титрование, когда на поляризуемом (индикаторном) электроде сначала происходит восстановление (или окисление) определяемого вещества, а после момента эквивалентности - титранта. При этом излом на кривой титрования в точке эквивалентности вызван различием в величинах коэффициентов диффузии этих веществ, а также в числе электронов. Примером такого вида титрования может служить определение ванадия (IV) раствором Се(IV). До точки эквивалентности V(IV), взаимодействуя с раствором Ce (IV), переходит в V(V), который, являясь электрохимически активным, восстанавливается на электроде. После момента эквивалентности на электроде протекает восстановление ионов Се(IV). Вид кривой титрования изображен на рис.1

№62
Опишите устройство рН-метра. Охарактеризуйте индикаторный электрод и электрод сравнения, применяемые в рН-метрах.
Решение
Прибор -рН-метр, представляет собой электронный вольтметр с высоким входным сопротивлением или потенциометр с электронным усилителем (вместо гальванометра). В последнем случае усиленный на несколько порядков ток в цепи с исследуемым элементом можно детектировать грубым миллиамперметром.
Для измерения рН используют стеклянный электрод и электрод сравнения (каломельный).
Наиболее распространен стеклянный электрод, который представляет собой тонкостенный шарик из стекла специального состава (напр., 72% SiO2, 8% СаО, 20% Na2O), припаянный к стеклянной трубке. Внутрь шарика наливают 0,1 М р-р НСl и погружают в него хлорсеребряный электрод (серебряная проволока в насыщенном растворе AgCl)- внутренний электрод сравнения. Чувствительной к ионам Н+ является только стеклянная мембрана на кончике электрода, которую предварительно хорошо вымачивают в 0,1 М растворе НСl.
Каломельный электрод сравнения изготавливают, используя ртуть и растворы каломели в хлориде калия. Электродная реакция на этом электроде отвечает уравнению: 2Hg + 2Сl-![]() Hg2Cl2, а соответствующее уравнение Нернста имеет вид:
Hg2Cl2, а соответствующее уравнение Нернста имеет вид:
![]()
где E0 - стандартный потенциал. В зависимости от концентрации КС1 различают насыщенный, нормальный и децинормальный каломельные электроды сравнения. Эти электроды сравнения хорошо воспроизводимы, устойчивы и пригодны для работы при температурах до 80 °С. При более высоких температурах начинается разложение хлорида ртути. Часто каломельный электрод сравнения подсоединяют через солевой мостик, состоящий из концентрированного раствора КС1 для снижения диффузионного потенциала. Потенциал Е каломельного электрода сравнения зависит от температуры, причем температурный коэффициент минимален для децинормального электрода, для которого Е =0,3365 - 6 х 10-5(t-25), где t - температура (°С).
