Коллоидная химия и поверхностные явления
Содержание
Поверхностные явления
Свойства межфазовой границы. Поверхностное натяжение
Адгезия и когезия
Смачвание
Адсорбция
Адсорбция на однородной плоской поверхности раздела фаз – в поверхностном слое жидкостей
Поверхностно-активные вещества. Правило Дюкло-Траубе
Адсорбция на твёрдой поверхности
Мономолекулярная адсорбция на твёрдой поверхности. Уравнение изотермы Ленгмюра
Полимолекулярная адсорбция. Уравнение БЭТ
Уравнение изотермы адсорбции Фрейндлиха
Вид изотерм адсорбции по классификации БДДТ
Ионная адсорбция. Иониты. Двойной электрический слой
Хроматография
Коллоидная химия. Дисперсные системы
Лиофильные и лиофобные золи. Получение лиофобных золей
Мицеллярная теория коллоидов
Устойчивость и коагуляция лиофобных золей
Седиментация. Коэффициент Сведберга
Оптические свойства коллоидов
Молекулярно-кинетические свойства коллоидов. Броуновское движение
Поверхностные явления
Фаза – это часть гетерогенной системы, однородная по химическому составу и физическим свойствам и ограниченная от остальной системы границей раздела. Явления, происходящие на границе раздела двух фаз, называются поверхностными явлениями.
Свойства межфазовой границы. Поверхностное натяжение
На границе раздела фаз каждая из граничащих фаз имеет избыток потенциальной энергии, который называется поверхностная энергия. Стремление вещества уменьшить поверхностную энергию – поверхностное натяжение у. Существует оно потому, что состояние молекулы внутри фазы и на её границе различно:
1. Внутри фазы молекула окружена другими такими же молекулами. Силовые поля этих молекул полностью компенсированы друг другом, молекулы связаны между собой одинаково
2. На границе раздела фаз молекулы рассматриваемой фазы одновременно взаимодействуют с молекулами как своей, так и другой фазы, причём характер взаимодействия между молекулами разных фаз другой, нежели между молекулами одной фазы. Это приводит к тому, что молекулы рассматриваемой фазы «выталкиваются» из своей фазы в другую или сильнее притягиваются к молекулам другой фазы, чем к «своим» молекулам
3. Поверхностное натяжение – это величина свободной энергии Гиббса на единицу поверхности вещества. Стремление вещества уменьшить эту величину приводит к самопроизвольному сокращению границы раздела фаз. Примеры: круглая форма капли жидкости при отсутствии воздействий со стороны (в невесомости, при достаточно малом объёме жидкости (поверхностное натяжение сильнее силы тяжести)), коагуляция, коалесценция и др.
4. Если площадь поверхности равна Щ, то при Р, Т=const
у = (dG/dЩ)P,T,nj (1)
Щ = ЩудV (2),
где Щуд – удельная поверхность фазы. Для сферических частиц
Щуд = 6/d (3),
d – диаметр частиц
5. Экспериментально можно определить лишь величину поверхностного натяжения. Существуют статические и полустатические (метод отрыва кольца) методы
Адгезия и когезия
1. Адгезия – это сцепление друг с другом поверхностей разнородных тел. Когезия – это сцепление друг с другом поверхностей одного тела. Обусловлены данные явления межмолекулярными взаимодействиями
2. Работа когезии Wc– это работа, затрачиваемая на преодоление сил сцепления между молекулами однородной жидкости и приводящая к возникновению двух новых поверхностей раздела фаз газ-жидкость. Wc = 2у. Работа адгезии Wа – это работа, затрачиваемая на преодоление сил сцепления между молекулами двух разных жидкостей на площади контакта 1 м2. Для жидкостей А и В:
Wа = уА + уВ - уАВ (4)
3. Растекание жидкости А по поверхности жидкости В возможно в тех случаях, когда энергия взаимодействия молекул жидкости А друг с другом меньше энергии взаимодействия молекул жидкости А с молекулами жидкости В. Высокая работа адгезии наблюдается у клеев, по адгезионным свойствам различаются нормальные и раковые клетки
Смачивание
1. Смачивание – это явление на границе раздела жидкой и твёрдой фаз, заключающееся в растекании жидкости по поверхности твёрдого тела, пропитывании пористых тел и порошков с образованием мениска за счёт взаимодействий молекул жидкой и твёрдой фаз
2. Если поверхностное натяжение на границе газ-жидкость равна уж-г, поверхностная энергия на границе твёрдое вещество-жидкость утв-г, поверхностная энергия твёрдой поверхности утв, то существует такой угол и, что
утв- утв-г+ уж-гcosи=0 (5)
Это – краевой угол смачивания (угол между направлением силы поверхностного натяжения на границе газ-жидкость и твёрдой поверхностью)
3. Критерий смачивания
В=cosи (6)
4. Из формулы
B = (2 Wа - Wc)/ Wc (7)
следует, что чем больше разница между работой адгезии и работой когезии данной жидкости в отношении данного вещества, тем лучше данная жидкость смачивает данное вещество. Это означает, что жидкость будет хорошо смачивать вещество, если энергия взаимодействия молекул жидкости между собой меньше энергии взаимодействия молекул жидкости и твёрдой поверхности
Адсорбция
1. Адсорбция – это концентрирование вещества на границе раздела фаз в результате его самопроизвольного перехода данного вещества из объёма фазы. Адсорбционное равновесие определяется притяжением молекул к поверхности другой фазы и тепловым движением, стремящимся восстановить равенство концентраций в поверхностном слое и объёме фазы
2. Наблюдается адсорбция на поверхностях раздела следующих фаз: твёрдое вещество-жидкость, твёрдое вещество-газ, жидкость-жидкость, жидкость-газ. Адсорбент – твёрдое вещество, на поверхности которого происходит адсорбция. Адсорбтив (адсорбат) – вещество, концентрирующееся на границе раздела фаз
3. Адсорбция – частный случай сорбции. Если на границе раздела фаз вещество поглощается в результате образования химических соединений, это хемосорбция. Если вещество поглощается объёмом другой фазы, это абсорбция
4. Различают два случая адсорбции: адсорбция на твёрдой поверхности и адсорбция в поверхностном слое жидкости.
Адсорбция на однородной плоской поверхности раздела
фаз – в поверхностном слое жидкостей.
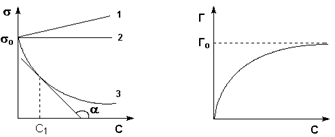
1. Данный процесс описывается уравнением изотермы адсорбции Гиббса
2. При контакте двух жидких фаз образуется межфазная область, толщина которой соответствует молекулярным размерам. Та как её измерить невозможно, для устранения неопределённости вводится условная разделяющая поверхность с площадью O
3. Тогда поверхностная энергия системы равна
G(s) = уO + ∑мini(s) (8)
4. Путём расчётов получаем
dу = -еdT - ∑Гidмi (9)
5. При дальнейших расчётах исходить из предположения, что адсорбция растворителя отсутствует
6. Уравнение изотермы адсорбции Гиббса Гi = -(ai/RT)(dу/dai), Гi – избыточное количество вещества i, отнесённое к единичной поверхности, ai – его активность
7. Экспериментальные данные дают хорошее качественное согласие с уравнением изотермы адсорбции Гиббса, повышение точности измерений подтверждает справедливость данного уравнения