Методы определения хлорид-ионов
Введение
Защите окружающей среды от возрастающей антропогенной нагрузки в настоящее время уделяется все большее внимание во всем мире. Развитие промышленности, в том числе и химической, увеличение добычи ископаемого сырья, расширение использования транспорта сопровождается поступлением в окружающую среду больших количеств различных загрязняющих веществ.
Сильное загрязнение окружающей среды (воды, воздуха, почвы) приводят к возникновению неблагоприятных последствий: нарушению нормальной жизнедеятельности биосферы, изменению климата, исчезновению многих видов растений и животных, ухудшению здоровья населения.
Для предотвращения или снижения загрязнения издаются природоохранительные законы и проводятся различные мероприятия – технологические, санитарно-технические, технические, правовые, медицинские и т.п. В основе всех мероприятий лежит контроль за содержанием вредных веществ, который регламентируется санитарно-гигиеническими нормативами – ПДК. Контроль необходим для получения информации об уровне загрязнения, а также об источниках выбросов, причинах и факторах, определяющих загрязнение. Полученные данные позволяют выбирать или проводить защитные, оздоровительные мероприятия и следить за их выполнением.
К качеству контроля предъявляются требования надежности и точности, применяемые методы должны быть достаточно чувствительны и избирательны. Независимо от техники выполнения надежность результатов анализа зависит от учета возможных химических, фотохимических и биохимических превращений загрязняющих веществ в разных средах, а также возможности миграции их из одной среды в другую. Данные о загрязнении одной среды должны увязываться с данными о загрязнении другой среды.
1. Распространение хлорид-иона
Хлорид-ион образуется в результате растворения и сольватации ионных солей, содержащих анион хлора (хлориды). Следовательно, существование хлорид-иона возможно только в водных растворах. В почвах хлорид ион может также содержатся в составе кристаллических солей. В природе хлор представленный хлорид ионом имеет значительное распространение: 0,02% от массы земной коры. Для сравнения это столько же, сколько и углерода или в 10 раз больше чем свинца. Самые распространенные минералы, содержащие хлорид ион: галит NaCl, сильвинит NaCl*KCl, карналлит KCl*MgCl2. Хлориды тяжелых металлов нерастворимы, хлориды щелочных и щёлочноземельных металлов растворимы все. Значительная растворимость хлоридов обусловила их распространение на планете. Основным местонахождением хлоридов является Мировой океан. По содержанию солей воды мирового океана являются хлоридно-натриевыми. Средняя концентрация хлорид-иона составляет 546 ммоль/л (19 г./л). Значительное содержание хлоридов во внутренних водоёмах явление редкое. Оно колеблется в пределах 5–80 мг/л. Повышенное содержание хлоридов объясняется загрязнением водоема сточными водами некоторых производств. Однако тому причиной может быть и выщелачивание материнской породы содержащей хлоридные соли.
Содержание хлорид иона в поверхностных слоях почвах, также не может достигать значительных величин вследствие интенсивного вымывания хлоридов под воздействием атмосферных осадков. Однако возможно присутствие значительных концентраций хлоридов в следующих случаях:
– вследствие засоления почв в результате подъёма высокоминерализованных подземных вод;
– в результате постоянного притока вод с последующим испарением жидкости.
Отсюда два различных местанахождения хлоридов. В первом случае это жидкость влажной почвы, а во втором растворённые хлориды образуют включения кристаллических солей в грунте.
2. Методы определения хлорид-иона
2.1 Общие положения
Необходимость определения хлорид-ионов возникает при анализе различных веществ, природных, питьевых и сточных вод. Контроль содержания хлорид-ионов требует различных уровней – от макроконцентраций до 10-7% в особо чистой воде. Существующие государственные стандарты (ГОСТы), регламентируют, какое веществом каким методом и с помощью какого оборудования нужно определять. Современные нормативные документы, регламентирующие процедуру контроля содержания загрязнителей в водах различного происхождения, разрешают использование химических, физико-химических и физических методов анализа. Основная масса лабораторий, проводящих мониторинг вод, не всегда располагает современным оборудованием для реализации физических методов анализа, позволяющих быстро, правильно и точно определять концентрацию загрязнителей. Наиболее массово по-прежнему представлены химические методы. Возможности разработанных на основе этих методов методик определения содержания в воде неорганических загрязнителей не всегда удовлетворяют требованиям ГОСТ, особенно при анализе вод природного происхождения. Многие загрязнители в воде можно обнаруживать разными способами, на разном оборудовании, но разные методы анализа дают различную погрешность, некоторые могут не учитывать какие-либо мешающие факторы. Определение хлоридов в этом отношении имеет ряд преимуществ. Их содержание редко пускается до микроконцентраций, и поэтому основные методики определения хлоридов всё ещё остаются методами «мокрой» химии. Однако в последнее время инструментальные методы применяются все чаще. Инструментальные методы позволяют автоматизировать анализ, сделать его экспрессным, значительно уменьшают расход вспомогательных реактивов. Определение хлоридов можно проводить такими методами:
– титриметрия;
– потенциометрия;
– нефелометрия;
– кондуктометрия;
Титриметрическое определение хлоридов может выполняться как химическими так и инструментальными методами анализа.
2.2 Химические методы определения хлорид иона
2.2.1 Требования к титриметрическим методам определения Титриметрические определения хлоридов, основаны на реакциях образования осадков малорастворимых соединений. Не все реакции сопровождающиеся выпадением осадков применимы в объемном анализе. В этих реакциях пригодны только некоторые реакции, удовлетворяющие определенным условиям. Реакция должна протекать строго по уравнению и без побочных процессов. Образующийся осадок должен быть практически нерастворимым и выпадать достаточно быстро, без образования пересыщенных растворов. К тому же необходимо иметь возможность определять конечную точку титрования с помощью индикатора. Наконец, явления адсорбции (соосаждения) должны быть выражены при титровании настолько слабо, чтобы результат определения не искажался.Наименования отдельных методов осаждения происходят от названий применяемых растворов. Метод, использующий раствор нитрата серебра, называют аргентометрией. Тиоцианатометрия основана на применении раствора тиоцианата аммония NH4SCN (или калия KSCN) и служит для определения следов С1- в сильнощелочных и кислых растворах. Дорогостоящий аргентометрический метод определения галогенидов по возможности стараются заменять меркурометрическим. В последнем используют раствор нитрата ртути (I) Hg2(NO3)2.
2.2.2 АргентометрияОбъемный аналитический метод, основанный на реакциях осаждения ионов галогенов катионами серебра с образованием малорастворимых галогенидов: Cl-+Ag+= AgCl↓ При этом используют раствор нитрата серебра. Если же анализируют вещество на содержание серебра, то пользуются раствором хлорида натрия (или калия).Для понимания метода аргентометрии большое значение имеют кривые титрования. В качестве примера рассмотрим случай титрования 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрита серебра (без учета изменения объема раствора). 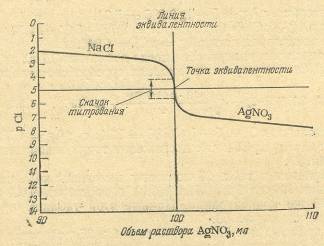 Рисунок 2.1 – Кривая титрования раствора NaCl раствором AgNO3 До начала титрования концентрации хлорид-ионов в растворе равна общей концентрации хлорида натрия, т.е. 0,1 моль/л или [Cl-]=l0-1.Обозначив отрицательный логарифм концентрации (или активности) определяемых хлорид-ионов через рСl, можно написать: рCl = – lg [Cl-] = – lg l0-1= 1. Когда к титруемому раствору хлорида натрия будет прибавлено 9,00 мл раствора нитрата серебра и 90% хлорид-ионов будут осаждены, концентрация их в растворе уменьшится в 10 раз и станет равна 10-2 моль/л, а рС1 будет равен 2. Поскольку же величина ПPAgCl=10-10, концентрация ионов серебра при этом составит: [Ag+] = 10-10/[С1-] = 10-10/10-2 = 10-8 моль/л,или pAg= – lg[Ag+] = – lgl0-8 = 8. Аналогичным образом вычисляют все остальные точки для построения кривой титрования. В точке эквивалентности pCl=pAg= 5 (см. табл. 2.1). Таблица 2.1 – Изменение рСl и pAg при титровании 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрата серебра
Рисунок 2.1 – Кривая титрования раствора NaCl раствором AgNO3 До начала титрования концентрации хлорид-ионов в растворе равна общей концентрации хлорида натрия, т.е. 0,1 моль/л или [Cl-]=l0-1.Обозначив отрицательный логарифм концентрации (или активности) определяемых хлорид-ионов через рСl, можно написать: рCl = – lg [Cl-] = – lg l0-1= 1. Когда к титруемому раствору хлорида натрия будет прибавлено 9,00 мл раствора нитрата серебра и 90% хлорид-ионов будут осаждены, концентрация их в растворе уменьшится в 10 раз и станет равна 10-2 моль/л, а рС1 будет равен 2. Поскольку же величина ПPAgCl=10-10, концентрация ионов серебра при этом составит: [Ag+] = 10-10/[С1-] = 10-10/10-2 = 10-8 моль/л,или pAg= – lg[Ag+] = – lgl0-8 = 8. Аналогичным образом вычисляют все остальные точки для построения кривой титрования. В точке эквивалентности pCl=pAg= 5 (см. табл. 2.1). Таблица 2.1 – Изменение рСl и pAg при титровании 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрата серебра
| Прибавлено раствора AgNO3, мл | [С1-] | [Ag+] | рСl | pAg |
| 0 | 10-1 | 0 | 1 | - |
| 9.00 | 10-2 | 10-8 | 2 | 8 |
| 9.90 | 10-3 | 10-7 | 3 | 7 |
| 9.99 | 10-4 | 10-6 | 4 | 6 |
| 10.00 (точка эквивалентности) | 10-5 | 10-5 | 5 | 5 |
| 10,01 | 10-6 | 10-4 | 6 | 4 |
| 10,10 | 10-7 | 10-3 | 7 | 3 |
| 11,00 | 10-8 | 10-2 | 8 | 2 |
| 20,00 | 10-9 | 10-1 | 9 | 1 |
