Методы получения наночастиц
2.5 Термолиз
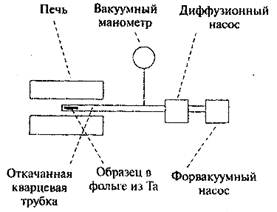
Рис. 4. Установка для получения наночастиц металла путем термического разложения твердого вещества, содержащего катионы металла, молекулярные анионы или металлорганические соединения
Наночастицы могут образовываться в результате разложения при высокой температуре твердых веществ, содержащих катионы металлов, молекулярные анионы или металлорганические соединения. Такой процесс называется термолизом. Например, малые частицы лития можно получить разложением азида лития LiN3. Вещество помещается в откачанную кварцевую трубку и нагревается до 400оC в установке, показанной на рис. 4. При температуре около 370оС азид разлагается с выделением газообразного N2, что можно определить по увеличению давления в вакуумированном пространстве. Через несколько минут давление падает до первоначального уровня, показывая, что весь N2 удален. Оставшиеся атомы лития объединяются в маленькие коллоидные металлические частицы. Таким методом можно получить частицы с размерами менее 5 нм. Частицы можно пассивировать, вводя в камеру соответствующий газ.
2.6 Термическое разложение и восстановление
В процессах термического разложения обычно используют сложные металлорганические соединения, гидроксиды, карбонилы, формиаты, нитраты, оксалаты, амиды и амиды металлов, которые при определенной температуре распадаются с образованием синтезируемого вещества и выделением газовой фазы.
Например, пиролизом формиатов железа, кобальта, никеля, меди в вакууме или инертном газе при температуре 470 – 530 К получают дисперсные порошки металлов со средним размером частиц 100 – 300 нм. Нанокристаллический порошок нитрида алюминия (AlN) со средним размером частиц 8 нм получали разложением в аммиаке при 900 К полиамида алюминия. Бориды переходных металлов можно получать пиролизом борогидридов при 600 – 700 К, то есть при температуре, которая гораздо ниже обычных температур твердофазного синтеза.
В общем виде основную реакцию пиролиза формиатов можно представить в виде следующего результирующего уравнения:
![]() (HCOO)n Me MeO + H2 + CO + H2O + Me
(HCOO)n Me MeO + H2 + CO + H2O + Me
При этом реакция восстановления оксидов металлов газами CO и H2, выделяющимися при пиролизе, рассматривается как вторичная. По той же схеме происходит разложение формиатов Cu и Zn и других металлов.
Следует отметить, что при пиролизе формиатов Cu и Ni преобладает выход свободного металла, а при пиролизе формиатов Mn и Fe – выход оксидов металлов. Другие формиаты металлов могут занимать промежуточное положение; например, пи пиролизе формиата кобальта образуются 50-60 % CoO и 50-40 % Co/
Исследования показали, что температура разложения формиатов повышается в ряду Fe Ni Co Cu, а скорость реакции разложения возрастает в обратном порядке.
Термическое разложение оксалатов многих металлов (Mn, Fe, Cu) протекает по уравнению
![]() MeC2 O4 MeO + Co + CO2
MeC2 O4 MeO + Co + CO2
Пиролиз оксалатов, формиатов и других солей позволяет получать порошки с размером частиц около 100 нм.
Путем термической диссоциации карбонилов при температуре до 773 К по реакции возможно получение полиметаллических пленок с размерами кристаллитов порядка 20 нм.
![]() Men (CO)m nMe + mCO
Men (CO)m nMe + mCO
Характерной особенностью термического разложения является сравнительно невысокая селективность процесса, поскольку продукт реакции обычно представляет собой смесь целевого продукта и других соединений.
Метод восстановления используют для получения наноматериалов (чаще всего металлов) из исходных кислородосодержащих соединений. При переработке оксидов металлов в качестве восстановителей используют газы – водород, монооксид углерода, конвертированный природный газ. Этим процессам соответствуют реакции в результате которых получают нанопорошки металлов: Fe, W, Ni, Mo, Cu, Co.
![]() MeO + H2 Me + H2O (пар),
MeO + H2 Me + H2O (пар),
![]() MeO + CO Me + CO2,
MeO + CO Me + CO2,
Распространенным методом получения высокодисперсных металлических порошков является восстановление соединений металлов (гидрооксидов, хлоридов, нитратов, карбонатов) в токе водорода при температуре менее 500 К. достоинствами этого метода являются низкое содержание примесей и узкое распределение частиц порошка по размерам.
3. Получение наночастиц в жидкой фазе
3.1 Химическая конденсация
Химические методы получения наночастиц и ультрадисперсных систем известны достаточно давно. Коллоидный раствор золя золота (красного) с размером частиц 20 нм был получен в 1857г. М.Фарадеем. Агрегативная устойчивость золя объясняется образованием двойного электрического слоя на поверхности раздела твердое тело-раствор и возникновением электростатической составляющей расклинивающего давления, являющегося основным фактором стабилизации данной системы.
Наиболее простым и часто используемым способом является синтез наночастиц в растворах при протекании различных реакций. Для получения металлических наночастиц применяют реакции восстановления, при которых в качестве восстановителя используют алюмо- и борогидриды, тетрабораты, гипофосфиты и многие другие неорганические и органические соединения.
Наноразмерные частицы солей и оксидов металлов получают чаще всего в реакциях обмена и гидролиза. Например, золь золота с размером частиц 7 нм может быть получен восстановлением хлорида золота боргидридом натрия с использованием в качестве стабилизатора додекантиола. Тиолы широко используются для стабилизации наночастиц полупроводников.
В качестве стабилизаторов используют и другие органические соединения, способные образовывать поверхностные комплексы.
Реакцию гидролиза проводят в органических растворителях. Последующая полимеризация приводит к образованию геля:
![]() M(OR)4 + 4H2O M(OH)4 + 4ROH
M(OR)4 + 4H2O M(OH)4 + 4ROH
![]() mM(OH)n (MO2) + 2mH2O
mM(OH)n (MO2) + 2mH2O
Этот метод обладает чрезвычайно широкими возможностями и позволяет получать материалы, содержащие и биологически активные макромолекулы.
3.2 Осаждение в растворах и расплавах
Осаждение в растворах. Общие закономерности образования наночастиц в жидких средах зависят от множества факторов: состава и свойств исходного вещества (раствора, расплава); характера диаграммы равновесия фаз рассматриваемой системы; способа создания пересыщения раствора или расплава; используемого оборудования и режимов его работы.
В случае синтеза необходимых фаз проводят термообработку порошка после его сушки или эти фазы объединяют в оду. После термообработки проводят дезагрегацию агрегатов до размеров наночастиц.
Исходные вещества и растворитель выбирают так, чтобы побочные продукты можно было полностью удалять из целевого продукта при промывании и последующей термообработки без загрязнения окружающей среды. Для эффективного смешения реагентов используют перемешивающие устройства с различными типами мешалок (пропеллерные, стержневые, турбинные), циркуляционное перемешивание с помощью насосов (центробежных и шестеренчатых), диспергирующих устройств (форсунки, сопла, инжекторы, вращающиеся диски, акустические распылители и так далее).
