Методы синтеза хинолинов и изохинолинов
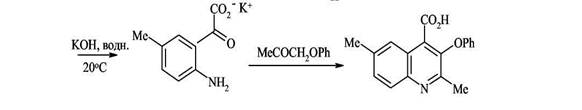
Интересно отметить, что при использовании ацетоуксусного эфира в зависимости от условий реакции могут образовываться 2-метилхинолоны-4 или 4-метилхнолоны-2. Атака аминогруппы по кетонному карбонилу (образование 2-метилхинолонов-4) кинетически контролируемый процесс, который протекает при низких температурах
(~ 20°С). Атака по сложноэфирной группе предпочтительна термодинамически и происходит, когда реакцию ведут при 110-140°С (образование 4-метилхинолона-2). Полученный продукт конденсации циклизируется с образованием изомерного 2-хинолона. Таким образом этот синтез позволяет контролировать направление циклизации.
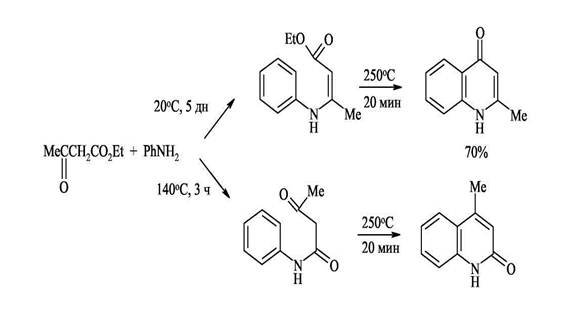
50%
Образование связи по типу II
1. Синтез из орто-ациланилинов и карбонильных соединений, содержащих
α- метиленовую группу (синтез Фридлендера).
Хинолины можно получить конденсацией орто-ациланилинов с кетонами или альдегидами(последние должны содержать α-метиленовую группу), катализируемой кислотами или щелочами. Формально такого типа конденсация заключается в образовании основания Шиффа и последующей конденсации альдольного типа с участием арильного карбонила и активной метиленовой группы.
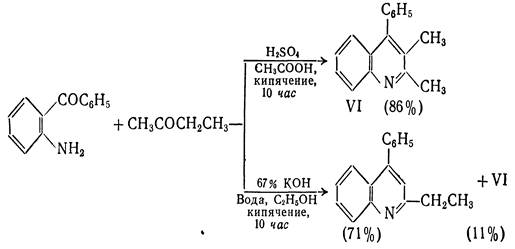
Из выше приведённых примеров видно, что ориентация конденсации, а следовательно, и циклизации зависит от условий реакции. В кислой среде карбонильное соединение реагирует в виде нейтрального С3-енола, в щелочной - в виде С1-енолят аниона. Аналогичные закономерности наблюдаются и при альдольной конденсации метилэтилкетона в средах различной кислотности и основности.
Поскольку орто-ациланилины труднодоступны, используют конденсацию орто-нитрокарбонильных предшественников с активными метиленовыми компонентами с последующей восстановительной циклизацией.
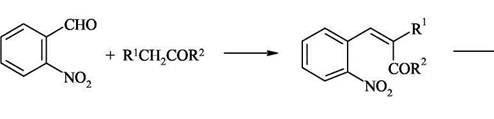
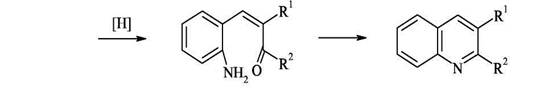
2.Синтез Пфитцингера
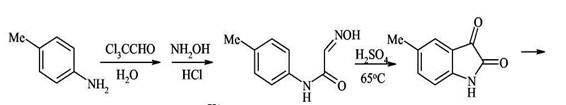
Предыдущий синтез основан на применении малодоступных орто-бензальдегидов, и в этом варианте метода Фридлендера вместо них используют гораздо более доступные замещённые изатины.
Синтез Пфитцингера заключается в щелочным гидролитическом раскрытии пятичленного кольца изатина и последующей конденсации образующегося аниона орто-аминофенилглиоксиловой кислоты с кетонами. Исходный изатин легко и высокими выходами на всех стадиях можно получать из доступных реагентов:
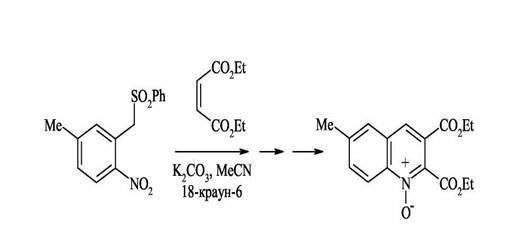
3.Конденсация орто-нитроарилбензилсульфонов с эфирами малеиновой или фумаровой кислот
Исходные орто-нитробензиларилсульфоны очень удобно получать по реакции викариозного нуклеофильного замещения. Наличие в исходных структурах сульфонильной группы, обладающей способностью легко элиминироваться в виде арилсульфоновой кислоты, позволяет сразу получать ароматические структуры, не прибегая к дополнительному окислению. Процесс идет через несколько стадий и завершается образованием N-оксида 2,3-ди(этоксикарбонил)хинолина.
Образование связи по типу III
1. Реакция Бунзла
Реакция, при которой в качестве конечного продукта образуется хинальдин:
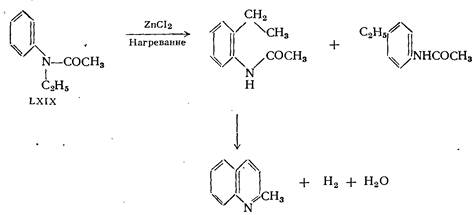
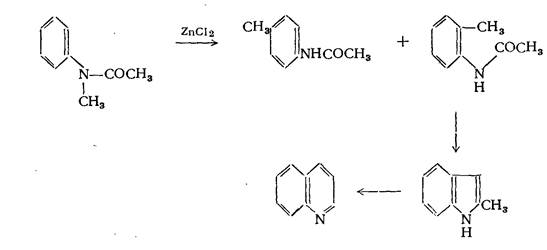
При нагревании N-ацетиэтиланилина с хлористым цинком наряду с пара-этилацетанилидом образуются небольшие количества хинальдина. Течение реакции может быть уяснено, если допустить, что под влиянием хлористого цинка происходит мигрирование этильной группы в соединении:
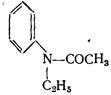
частично в орто- и частично в пара-положение. N-ацетилметиланилин в аналогичной реакции даёт хинолин. Образование хинолина в этой реакции нельзя объяснить таким же образом, как и образование хинальдина в приведённой выше реакции. Было высказано предположение, что образование хинолина может происходить через стадию получения 2-метилиндола.
Образование связи по типу IV
1. Реакция Чиоза
Это одна из первых известных реакций замыкания хинолинового цикла, которая заключается в образовании карбостирила при восстановлении о-нитрокоричной кислоты:
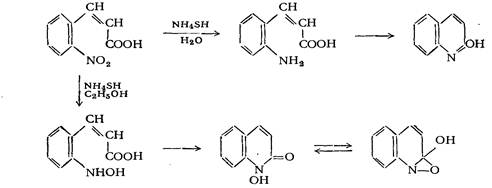
Вместо гидросульфида аммония в качестве восстановительного агента может быть применена гидроокись двухвалентного железа.
2. Синтезы на основе превращений этилового эфира о-нитрокоричной кислоты
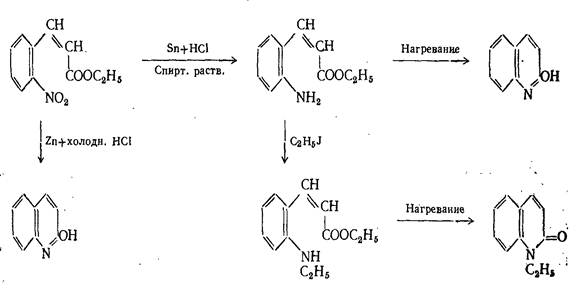
Глава II
Изохинолины
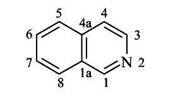
Стратегии построения изохинолинового скелета:
C(1)-N
C(ia)-C(i) С(4)-С(4а)
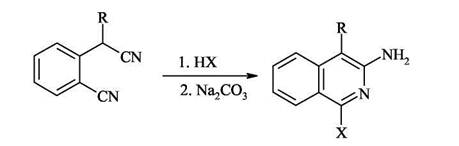
Образование связи C(1)-N Циклизация 2-цианобензилцианидов под действием галогенводородных кислот
Этот региоселективный синтез изохинолинов идет по механизму динитрильной конденсации под действием НВг или HI (применение НС1 неэффективно).
Образование связи C(1)-C(1a)
1. Синтез из активированных фенилэтиламинов с формальдегидом (синтез Пикте-Шпенглера)
Образующиеся при взаимодействии фенилэтиламинов с альдегидами альдимины в кислой среде электрофильно циклизуются по бензольному кольцу с образованием 1,2,3,4-тетрагидроизохинолинов. Для успешного осуществления циклизации бензольное кольцо должно быть активировано к электрофильной атаке наличием электронодонорных заместителей, поскольку образующиеся при действии кислоты на имины иминиевые соли - достаточно слабые электрофилы.
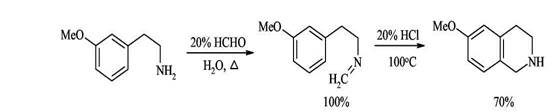
Циклизация успешно идет при наличии донорных заместителей в пара-положении к месту атаки, если такие заместители расположены в других положениях бензольного кольца реакция не идет.

2. Циклизация ацилированных фенилэтиламинов (синтез Бишлера-Напиральского)
Ацилированние фенилэтиламинов с последующей циклизацией под действием кислот Льюиса (Р2О5, PCl3, PCl5) приводит к 3,4-дигидроизохинолинам, легко дегидрирующимся в ароматические структуры. Циклизация в этом случае - обычный электрофильный процесс, поэтому она плохо идет при наличии в бензольном кольце электроноакцепторных заместителей.
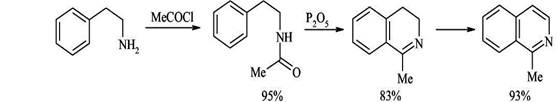
Из мета-замещенных фенилэтиламинов образуются только 6-изомеры, то есть циклизация идет исключительно в пара-положение по отношению к заместителю.
