Моделирование парожидкостного равновесия реакционной смеси в процессе получения метилциклопропилкетона
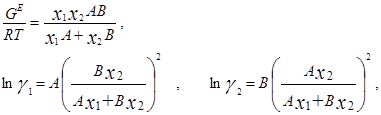
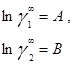
В модели Ван-Лаара величины А, В аналитически связаны с константами уравнения Ван-дер-Ваальса, однако выяснилось, что последние не обеспечивают адекватное описание систем, в частности, из-за большой чувствительности модели к произвольно выбранным комбинационным правилам для констант уравнения состояния. Если же рассматривать величины А, В как самостоятельные эмпирические параметры, оцениваемы по экспериментальным данным о бинарной системе, тогда соотношения превращаются в простые корреляционные уравнения, удовлетворительно описывающие многие системы[7].
Точность представленных выше моделей обычно удовлетворительна для систем малой или умеренной неидеальности и недостаточна для систем с большими отклонениями от идеального поведения.
Прогресс в методах расчета фазовых равновесий, наблюдающийся с середины 60-х гг., в значительной мере связан с появлением нового типа уравнений для GE и γi, за которыми закрепилось общее название – уравнения (модели) локального состава. При их выводе существенную роль, как это следует из названия, играет представление о локальном, микроскопическом составе раствора [7].
В моделях локального состава относительное различие локальных и средних концентраций компонентов связывают с разностью энергий взаимодействия одноименных и разноименных молекулярных пар распределением типа больцмановского.
Введение локальных концентраций в приближенные теоретические уравнения открывает дополнительные возможности для учета энергетики межмолекулярных взаимодействий.
Энергетические параметры моделей Сij носят полуэмпирический характер и оцениваются по экспериментальным термодинамическим данным.
То обстоятельство, что уравнения локального состава описываются на молекулярные модели растворов, обеспечивает им ряд преимуществ перед более ранними уравнениями для коэффициентов активности. Наиболее отчетливо эти преимущества проявляются в случае предсказания свойств многокомпонентных систем по данным для бинарных, при расчетах для неизотермических условий и при описании сильно неидеальных систем. Первое из уравнений такого рода было предложено в 1964 г. Вильсоном [7].
При разработке уравнения Вильсон исходил из тог, что межмолекулярные взаимодействия зависят в первую очередь от «локальных концентраций» ,которые он выражал в объемных долях [3].
Уравнение Вильсона для бинарной смеси для избыточной свободной энергии смешения и для определения коэффициентов активности имеет следующий вид:
![]()
где 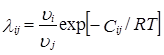
![]()
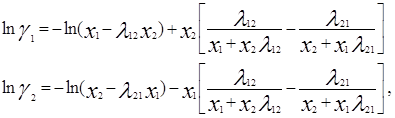
![]() - мольный объём j – го компонента;
- мольный объём j – го компонента; ![]() - мольная доля j – го компонента; член
- мольная доля j – го компонента; член ![]() - величина, пропорциональная энергии взаимодействия разноименных молекул; член
- величина, пропорциональная энергии взаимодействия разноименных молекул; член ![]() является константой, пропорциональной энергии взаимодействия между одноименными молекулами.
является константой, пропорциональной энергии взаимодействия между одноименными молекулами.
Уравнения для бинарной системы содержат два параметра, которые оценивают по экспериментальным данным для этой системы. Уравнения для многокомпонентного раствора содержат только параметры составляющих бинарных систем. Таким образом, равновесие в многокомпонентных системах предсказывается по данным о бинарных. В этом состоит главное преимущество уравнений Вильсона (и других уравнений локального состава) перед более ранними уравнениями для коэффициентов активности.
Другое достоинство модели Вильсона в приближенном учете влияния температуры на GE и γi. При Сij=const температурная зависимость передается через величины λij. Это облегчает описание парожидкостного равновесия в неизотермических условиях.
Серьезный недостаток модели Вильсона – ее неспособность описывать свойства расслаивающихся растворов (ни при каких значениях параметров модели не удовлетворяется термодинамическое условие неустойчивости системы относительно образования новой фазы).
Одна из модификаций уравнения Вильсона была предложена Цубокой и Катаямой. Для расчетов избыточной энергии Гиббса эти авторы используют следующее выражение:
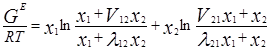
где Vij (=Vi/Vj) – соотношения молярных объемов, и если эти соотношения равны единице, то получаем уравнение Вильсона. Уравнения для определения коэффициентов активности бинарных смесей соответственно принимают следующий вид [3]:
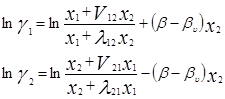
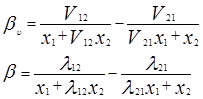
V12=V2/V1 ; V21=V1/V2
В системах с гомогенными растворами уравнение Цубоки – Катаямы дают в среднем те же результаты, что и уравнения Вильсона, однако, в отличие от последних, они применимы и к расслаивающимся растворам. По качеству описания равновесий жидких фаз они нередко превосходят уравнения NRTL, несмотря на меньшее число оцениваемых параметров.
Уравнение NRTL для избыточной энергии Гиббса выводят, основываясь на теории, согласно которой жидкость в двухкомпонентной смеси имеет ячеистую структуру. Причем эти ячейки состоят из молекул типа 1 и 2, каждая из которых окружена такими же молекулами, которые в свою очередь имеют аналогичное окружение, и т.д. Гиббсовы энергии взаимодействия между молекулами обозначают символом gij, где подстрочным индексом j указывают центральную молекулу; таким же образом обозначают и мольные доли в окружающих зонах хij.
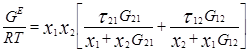
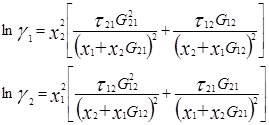
Gij=exp(-αijτij) ; τij=Cij/RT ; ![]()
Общее число независимых параметров уравнения, описывающего бинарный раствор, равно трем: αij, Cij, Cji. При недостаточно полной или недостаточно точной экспериментальной информации о системе оценка параметра αij ненадежна. В этом случае его значение часто задают априори – в соответствии с химической природой системы и следующими рекомендациями авторов уравнения:
αij = 0,2 для смесей насыщенных углеводородов с полярными неассоциированными жидкостями, для систем с малой взаимной растворимостью компонентов;
αij = 0,3 для систем с небольшими отклонениями от идеальности, для смесей воды с полярными растворителями;
αij = 0,4 для смесей насыщенных углеводородов с перфторуглеводородами;
αij = 0,47 для смесей полярных веществ (например, спиртов, пиридина) с неполярными веществами, с водой, для смесей полярных веществ с четыреххлористым углеродом.
