Неорганическая химия
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2¯
Образующийся осадок имеет характерный интенсивный синий цвет (турнбулева синь).
2. Химия неметаллов
Кремний
Кремний очень распространен в природе, содержание его в земной коре составляет 27,6 масс.% (он занимает второе место после кислорода).
Кремний в свободном виде в природе не встречается, но играет важную роль. Земная кора на 97 % состоит из соединений кремния; важнейшим из них является кремнезем SiO2 и силикатные минералы, представляющие собой сложные соединения, отличающиеся разнообразным составом и структурой.
Соединения кремния входят в состав растительных и животных организмов, они способствуют образованию твердых скелетных частей и тканей. Особенно много кремния могут накапливать некоторые морские организмы, как растительные – диатомовые водоросли, так и животные – кремневые губки, солнечники, скелет которых состоит из двуокиси кремния. Диатомовые водоросли и инфузории, погибая, образуют различные формы аморфного кремнезема: кизельгур, трепел, диатомит.
Таким образом, кремнезем в виде двуокиси кремния широко распространен в природе. Кремнезем бывает кристаллический и аморфный. Природной формой кристаллического кремнезема является минерал кварц. Он входит в состав горных пород: граниты, пегматиты.
Наиболее чистой природной разновидностью кварц является прозрачный, как вода, горный хрусталь. Окрашенные разновидности горного хрусталя известны как драгоценные камни: дымчатый – раухтопаз, черный – марион, фиолетовый – аметист. К микроволокнистым разновидностям кварца относятся халцедон, агат, яшма, кремень. Горный хрусталь и его разновидности применяются для изготовления оптических приборов и в ювелирном деле.
Кремнезем в виде различных песков используется в силикатной промышленности и в строительстве.
Землистые формы аморфного кремнезема – диатомит, трепел – имеют пористое строение, поэтому они обладают повышенной химической активностью, являются хорошими адсорбентами.
Кремнезем и его разновидности представляют неорганический полимер, построенный из тетраэдров SiO4. В центре правильного тетраэдра находится атом кремния в вершинах атомы кислорода. Кремний соединен с атомами.

Двуокись кремния – устойчивое соединение, которое в воде практически нерастворима; из кислот на нее действует только HF, при этом образуется тетрафторид кремния и вода:
SiO2 + 4HF = 2H2O + SiF4
Эта реакция используется при травлении стекла.
В обычных условиях щелочи очень слабо взаимодействуют с SiO2 с образованием солей кремневой кислоты – силикатов:
SiO2 + 2NaOH = H2O + Na2SiO3
Химическая активность модификаций SiO2 возрастает от кварца к аморфному кремнезему.
Аморфный кремнезем может вступать в химическое взаимодействие с щелочами и гашеной известью уже на холоду. На этом основано использование этих материалов в качестве гидравлических добавок в цементах. Имеющаяся в цементе известь взаимодействует с аморфным кремнеземом с образованием силикатов кальция. Этот процесс можно выразить следующим уравнением реакции:
SiO2 + Ca(OH)2 = H2O + CaSiO3
При сплавлении все модификации SiO2 легко взаимодействуют с основными оксидами, щелочами и карбонатами, например:
SiO2 + 2NaOH = H2O + Na2SiO3
SiO2 + Na2СО3 = СО2 + Na2SiO3
Кремневые кислоты и силикаты
Свободная кремневая кислота известна в виде нескольких форм: H4SiO4 или SiO2.2H2O – ортокремневая кислота; H2SiO3 или SiO2.H2O – мета кремневая кислота; H2Si2O5 или 2SiO2.H2O – двуметакремневая кислота.
Мономолекулярные кремневые кислоты неустойчивы и обычно конденсируются в полимерные практически нерастворимые в воде формы.
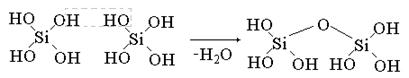
Кремневые кислоты слабее угольной кислоты.
Диссоциацию метакремневой кислоты можно представить уравнением реакции:
H2SiO3 D H+ + HSiO3- Кд1 = 2.10-10
HSiO3- D H+ + SiO32- Кд2 = 1.10-12
Диоксид кремния SiO2 в воде не растворяется, поэтому кремневая кислота получается косвенным путем – действием кислоты на растворимые силикаты:
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl
Поликремневые кислоты в воде не растворимы, легко образуют коллоидные растворы – золи. Устойчивость золей этих кислит зависит от рН раствора.
Строение мицеллы кремневой кислоты условно можно выразить формулой:
{[SiO2.mH2O]m.xHSiO3- (x-y)H+}-yyH+
Золи кремневых кислот обладают гидрофильными свойствами. Прибавлением электролитов не всегда удается вызвать коагуляцию. Для более быстрой коагуляции необходимо добавить баритовой воды или концентрированного раствора Al2(SO4)3
При коагуляции кремнево-кислых золей образуются гели переменного состава с общей формулой SiO2.хH2O.
Гель кремневых кислот представляет собой микрогетерогенную систему, состоящей из губчатой твердой фазы, в порах которой распределена вода. Высушенные гели кремневых кислот называются силикагелями. Они обладают сильно развитой внутренней поверхностью и являются хорошими сорбентами. Силикагель сильно поглощает пары воды, поэтому его используют для осушки газов.
Соли кремневых и поликремневых кислот называются силикатами.
В воде растворимы только силикаты щелочных металлов, остальные силикаты малорастворимы в воде.
