Нитрование n-нитроацетанилид
Введение
Нитрования – один из важнейших процессов в химической промышленности. Продукты, получаемые за счёт нитрования, являются полуфабрикатами для производства многих товаров различных назначений от взрывчатых веществ до продукции фармацевтической промышленности. Чаще всего нитросоединения являются промежуточными продуктами производство азокрасителей и других веществ. В данной работе рассмотрены способы получения нитросоединений, химические свойства, таутометрия соединений, а также применение нитросоединений в народном хозяйстве.
Целью УИРС является синтез n-нитроацетанилида.
n-Нитроацетанилид - аморфное вещество бледно-желтого цвета, трудно растворимое в большинстве органических растворителей, т. пл. 206 . 207 0С.
Литературный обзор
1. Нитрование и способы получения нитросоединений
Нитрование - введение нитрогруппы – NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам; активные частицы в этих реакциях - соответственно катион нитрония NO2, нитрит - ион NO2 и радикал NO2. нитрование может осуществляться по атомам С, N, О замещением атома водорода (прямое нитрование) или других функциональных групп (заместительное нитрование) либо в результате присоединения группы NO2; по кратной связи.
Нитрогруппу в молекулу ароматического углеводорода можно вводить различными путями; главным из них является нитрование углеводородов смесью азотной и серной кислот (нитрующая смесь) в жидкой фазе, последняя одновременно является катализатором процесса, водоотнимающим средством и веществом, способствующим более полному использованию азотной кислоты и препятствующим окислительным процессам. Но по механизму все способы нитрования ароматических углеводородов идут по электрофильному замещению.
Нитрования как процесс принято называть взаимодействие органического соединения с азотной кислотой или её производными, в результате которого атом водорода при одном или нескольких атомах углерода замещается нитрогруппой. В общем случае для процесса нитрования ароматических углеводородов (в ароматическое кольцо) можно написать уравнение:
ArH + NO2+ Ar-NO2 +H+
При нитровании только азотной кислотой реакция может быть выражена уравнением
ArH + HONO2 Ar-NO2 +H2O
Это уравнение даёт лишь общее представление о ходе реакции, но не характеризует всего сложного процесса нитрования, протекающего в несколько стадий; в действительности в реакцию с ароматическими углеводородами вступает не сама азотная кислота, а продукты её превращения.
Как видно из приведённого уравнения, при нитровании азотной кислотой введение каждой нитрогруппы в молекулу углеводорода сопровождается образованием молекулы воды. Это значительно уменьшает концентрацию азотной кислоты и понижает её нитрующую способность, а образующаяся слабая азотная кислота увеличивает степень окисления углеводородов. Поэтому нитрование углеводородов только азотной кислотой осуществляют крайне редко; в том случае необходим избыток азотной кислоты по сравнению с теоретически требуемым, а реакцию надо проводить при низких температурах, чтобы ослабить протекание нежелательных окислительных процессов.
Для связывания воды, выделяющейся в процессе нитрования, применяют водоотнимающие вещества – серную кислоту, полифосфорные кислоты, уксусных ангидрид, трёхфтористый бор. Серная кислота – наиболее доступное и дешёвое вещество для этих целей. Она эффективно связывает воду и переводит азотную кислот в активную нитрующую форму; это позволяет резко снизить расход азотной кислоты почти до теоретического.
Роль серной кислоты заключается не только в связывании реакционной воды. Ещё в 1889 г. В. В. Марковников установил, что наличие в реакционной среде серной кислоты ускоряет реакцию нитрования. Следовательно, серную кислоту можно рассматривать как катализатор этой реакции. Заводская практика подтвердила, что нитрование ароматических углеводородов смесью азотной и серной кислот протекает значительно быстрее, чем при действии безводной азотной кислоты, даже взято в большом избытке.
Для промышленных процессов нитрования (и сульфирования) в качестве водоотнимающего средства предложен трёхфтористый бор BF3 . при добавлении достаточного количества трёхфтористого бора реакции сульфирования и нитрования можно проводить стехиометрическими количествами соответствующих кислот (серной и азотной). Полагают, что реакции протекают по следующим схемам:
ArH + HNO3 + BF3 Ar-NO2 + BF3·H2O
ArH + H2SO4 + BF3 Ar-SO3H + BF3·H2O
По окончании реакции добавляют воду; при этом моногидрат фтористого бора превращается в дигидрат BF3·2H2O, который можно отогнать в вакууме. Далее его обрабатывают фтористым кальцием
2BF3·2H2O + CaF2 Ca(BF4)2 + 4H2O
и при нагревании регенерируют BF3:
Ca(BF4)2 2BF3 + CaF2
Особенности проведения нитрования зависят как от использующихся реагентов, так и от субстрата реакции.
Реагенты для проведения реакции нитрования
1. HNO3 (63-65%, d 1.35 г/мл, товарный продукт) + H2SO4 (96%). Наиболее распространенный.
2. HNO3 (98%, d 1.5 г/мл, также товарный продукт) + H2SO4 (96%-100 %). Для мало реакционноспособных соединений.
3. HNO3 (98%) + SO3 (4-63%), олеум. Для очень мало реакционноспособных соединений.
4. К(Na)NO3 или NH4NO3 + H2SO4 (96%). Распространенный реагент для получения полинитропроизводных.
5. HNO3 (98%, d 1.5 г/мл) + (CH3CO)2O (или СН3СООН). Для реакционноспособных соединений, селективный реагент. Реагент дорогой, поэтому необходимо обосновать экономическую целесообразность его использовании.
6. HNO3 (d 1,3 - 1,5). Для реакционноспособных соединений. Осложнение – побочная реакция окисления.
2. Химические свойства нитросоединений
Нитрогруппа отличается высокой стабильностью по отношению к электрофильным реагентам и разнообразным окислителям. Большинство нуклеофильных агентов за исключением литий- и магнийорганических соединений, а также литийалюминийгидрида не действуют на нитрогруппу. Нитрогруппа относится к числу превосходных нуклеофильных групп в процессах активированного ароматического нуклеофильного замещения ( SNAr). Так, например, нитрогруппа в 1,2,4- тринитробензоле легко замещается под действием гидроксид-, алкоксид-ионов или аминов.
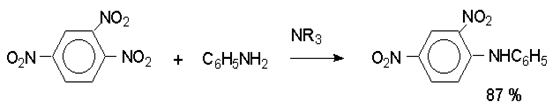
Наиболее важной реакцией ароматических нитросоединений является восстановление их до первичных аминов.
Эта реакция была открыта в 1842 году Н.Н.Зининым, который впервые восстановил нитробензол до анилина действием сульфида аммония. В настоящее время для восстановления нитрогруппы в аренах до аминогруппы в промышленных условиях применяется каталитическое гидрирование. В качестве катализатора используют медь на силикагеле в качестве носителя. Катализатор готовят нанесением карбоната меди из суспензии в растворе силиката натрия и последующим восстановлением водородом при нагревании. Выход анилина над этим катализатором составляет 98 %.

