Новые сложные гребнеобразные полиэфиры и полиамиды синтез, структура и свойства
Недавно был осуществлен синтез жесткоцепных ароматических гребнеобразных сложных полиэфиров и полиамидов, содержащих сложно-эфирные мезогенные боковые заместители [1]. Синтезированные полимеры оказались растворимы в обычных растворителях и плавились при нагревании (сложные полиэфиры) в отличие от своих незамещенных аналогов, что подтверждает теоретические прогнозы [2]. Из растворов и расплавов этих полимеров получены гибкие и прочные пленки. Полимеры синтезировали поликон денсацией хлорангидридов замещенных терефталевых кислот и n-фенилендиамина или гидрохинона. Чтобы исследовать зависимость свойств полимеров, имеющих то же самое строение полимерной цепи от природы и топологии замещения,1 мы синтезировали серию сложных полиэфиров и полиамидов, содержащих фрагмент дизамещенной терефталевой кислоты, на основе хлорангидрида замещенной терефталевой кислоты и полифенилендиамина или гидрохинона. Синтез мономера и полимеров показан на схеме I.
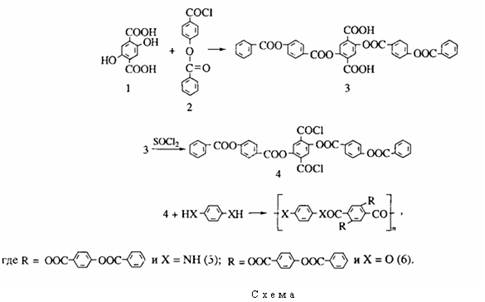
Все мезогенные группы были связаны с полимерной цепью сложноэфирными связями. Хлор-ангидрид 2 получали по методике [3]. Замещенную терефталевую кислоту 3 переводили в соответствующий хлорангидрид 4 кислоты кипящим тионилхлоридом в присутствии следов ДМФА. Хлорангидрид 4 был чрезвычайно плохо растворим даже в кипящем тионилхлориде и после окончания реакции его отфильтровывали от горячего тионилхлорида и перекристаллизовывали из ксилола.
Первоначально попытались получить полимер 5 из л-фенилендиамина и мономера 4 в среде N-метилпирролидона (МП), однако, полимер оказался нерастворим в этом растворителе и осаждался из реакционной смеси в процессе синтеза. Гомогенный раствор полимера образовывался в том случае, когда поликонденсацию вели в 5%-ном растворе LiCl в МП. Синтезированный полимер оказался нерастворим в МП, но растворялся в растворах солей LiCl и СаС12 в МП. Нам не удалось получить достаточно высокомолекулярные образцы полиамида 5 Спприв = 0.52 дл/г), вероятно, вследствие низкой растворимости ди-хлорангидрида в реакционной среде; не удалось также приготовить пленки из солевых растворов полиамида 5 из-за выпадения соли при испарении растворителя. Сравнивая растворимость полимера 5 с растворимостью аналогичного полимера, описанного в работе [1], можно отметить уменьшение растворимости при введении второго заместителя во фрагмент терефталевой кислоты. Мы полагаем, что это явление связано с симметричным расположением заместителей в полиамиде 5 в отличие от несимметричного замещения, имеющего место в полимере, описанном в работе [1]. При получении сложного полиэфира 6 из мономера 4 и гидрохинона использовали две различные методики. Первая - высокотемпературная поликонденсация в растворе, проведенная в дифениловом эфире при 200 - 250°С приводила к образованию нерастворимого и неплавкого полимера, который постепенно выделялся из реакционной смеси в ходе поликонденсации. Вероятно, в ходе высокотемпературной поликонденсации протекала переэтерификация, приводящая к образованию сшитого продукта. Другой метод поликонденсации - низкотемпературная поликонденсация в растворе, проведенная при 50°С в пиридине в течение нескольких часов, давала низкомолекулярный продукт с Гприв = =0.22 дл/г, который был растворим в смеси трифторуксусной кислоты с метиленхлоридом. Выпадение полимера из реакционной смеси происходило одновременно с растворением хлорангидрида. По нашему мнению, низкая молекулярная масса полимера 6 в этом случае связана с нерастворимостью полимера в пиридине.
В ИК-спектрах синтезированных полимеров присутствует полоса при 1735 см-1, связанная со сложноэфирным карбонилом, и отсутствует полоса при 1690 с-1, обусловленная концевыми карбоксильными группами. В ИК-спектрах полиамида 5 наряду с полосой сложного эфирного карбонила появляется полоса поглощения амидного карбонила при 1670 см-1. Эти результаты, наряду с данными элементного анализа подтверждают предложенные структуры полимеров.
2,5-Бис-( (4-бензоилокси)бензоилокси) терефталевая кислота (3)
Смесь 10 мл пиридина, 17 мл МП и 0.68 г (3.43 ммоль) 2,5-дигидрокситерефталевой кислоты (I) нагревали до 60°С для получения прозрачного раствора. После охлаждения смеси до -10°С 1.79 г (0.687 ммоль) хлорангидрида 2 прибавляли при перемешивании. Реакцию вели в течение 5 ч при 0°С, выливали содержимое колбы в воду, осадок отфильтровывали и перекристаллизовывали из смеси диоксан : уксусная кислота =1:1. Выход 62%, Тт = 261 - 262°С (разл.). Найдено, %: С 66.43; Н 3.86. С36Н22012. Вычислено, %: С 66.87; Н 3.43.
2,5-Бис-((4-бензоилокси)бензоилокси) терефшалоилхлорид (4)
3.5 г дикислоты 3 кипятили с обратным холодильником в свежеперегнанном тионилхлориде, содержащем следы ДМФА в течение 3 ч. Твердый продукт отфильтровывали в токе аргона и перекристаллизовывали из ксилола. Выход 44%, Гпл = 212 - 215°С. Найдено, %: С 63.21; Н 3.01. СзбН2о010С12. Вычислено, %: С 63.27; Н 2.95.
Полиамид (5)
0.18 г LiCl, высушенного в вакууме при 300°С и 0.2003 гр-фенилендиамина растворяли в 9 мл МП в токе аргона, после чего прибавляли за один прием 1.2656 г хлорангидрида 4 при -5°С и реакционную массу перемешивали в течение 5 ч при комнатной температуре. Полимер осаждали водой, отфильтровывали и сушили в вакууме при 100°С. Выход 93%, т|прив = 0.52 дл/г при 25°С в 0.5% растворе МП, содержащем 5% LiCl. Найдено, %: С 69.18; Н 4.05; N 4.13. (C42H26N2O10)n. Вычислено, %: С 70.19; Н 3.65; N 3.90.
Полиэфир (6)
Метод А. 0.4701 г хлорангидрида 4 и 0.0757 г гидрохинона растворяли в 6 мл свежеперегнанно-го дифенилового эфира в токе аргона. Поликонденсацию вели в течение 2 ч при 150°С и 3 ч при 220°С. В ходе поликонденсации полимер постепенно осаждался из реакционной смеси. После охлаждения реакционную смесь разбавляли метанолом, выпавший полимер отфильтровывали и сушили в вакууме при 100°С. Полимер не растворялся в обычных растворителях; выход 88%.
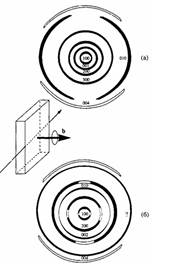
Рис. 1. Схемы рентгенограмм, полученных при съемке "в бок" для полимеров 5 (а) и 6 (б). Аморфное гало на схемах не обозначено.
Найдено, %: С 69.54; Н 3.33. (С42Н24012)„. Вычислено, %: С 70.00; Н 3.55.
Метод Б. К раствору 0.1841 г гидрохинона в 10 мл пиридина, в токе аргона прибавляли 1.1370 г хлорангидрида 4 при перемешивании, при 20°С. Реакционную массу нагревали до 50°С и перемешивали при этой температуре в течение 4 ч. После охлаждения смесь разбавляли эфиром, осажденный полимер отфильтровывали, промывали водой, ацетоном и сушили при 150°С в вакууме. Выход 87%, Лприв = 0.22 дл/г в CF3COOH-CH2Cl2 (1 : 1, по объему при 25°С, 0.5% концентрация. Найдено, %: С 69.82; Н 3.44. (С42Н24012)„. Вычислено, %: С 70.00; Н 3.55.
Синтезированные полимеры 5 и 6 представляли собой порошки. Из них можно было получить таблетки прессованием при давлении 250 атм и температуре 250 - 285°С. Таблетки были хрупкими, и повышение температуры не приводило к улучшению их деформируемости.
Макроскопическую плотность образцов р определяли методом пикнометрического титрования.
