Новые современные коагулянты в технологии очистки сточных вод
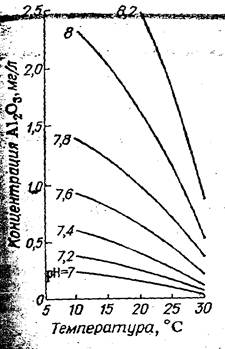
Рис. 2 Зависимость растворимости Гидроксида алюминия от температуры при различных рН
Для быстрого и полного протекания процесса гидролиза не обходим некоторый щелочной резерв воды для связывания ионов водорода выделяющих при гидролизе этим щелочным резервом могут быть бикарбонат – ионы, 3 присутствующие в воде, или специально введенные щелочные реагенты – известковое молоко, кальцинированная или каустическая сода [3,16].
В результате применения сульфата алюминия увеличивается степень сточной воды.
Очень перспективным коагулянтом является оксихлорид алюминияА12(ОН)5С1. В Японии этот коагулянт применяется с 1966 г. Он получается из гидроксида алюминия и соляной кислоты. Основные преимущества оксихлорида алюминия, по сравнению с глиноземом – большое содержание алюминия в продукте, меньшее снижение щелочности воды и меньшее повышение ее солесодержания. Оксихлорид имеет более сильное коагуляционное действие и большую скорость хлопьеобразования Хорошо растворяется в воде.
Для рекуперации белковых веществ из сточных вод рекомендуется использовать в качестве коагулянта лигносульфонат алюминия, получаемый из лигносульфоната натрия или путем ионообменной реакции.
В качестве коагулянтов могут быть применены алюмокалиевые квасцы [А1К(SО4)2*12NаОH] или алюмоаммонийные квасцы [А1 (NН4) (S04)2*12Н2O], имеющие меньшую стоимость и менее дефицитные, чем глинозем. Следует отметить, что при использовании алюмоаммонийных квасцов и наличии в очищаемой воде свободного хлора наблюдалось образование токсичных хлораминов.
Дешевыми коагулянтом является хлорид алюминия, который получают на нефтехимических комбинатах термическим гидролизом каталитического комплекса отработанного хлорида алюминия, применяемого в процессах изомеризации и при производстве этилбензола. Показана возможность использования этого коагулянта для очистки сточных вод производства синтетического спирта.
Известен коагулянт на основе алюминия, так называемый гидрокарбоалюминат кальция в виде однородного порошка серо-белого цвета. Гидрокарбоалюминат кальция получают как попутный продукт производства глинозема способом гидрохимического синтеза кальция из щелочно-карбоалюминатных растворов и извести при комплексной переработке нефелинов. Недостатками этого коагулянта – гидрокарбоалюмината кальция – являются высокая его стоимость и дефицитность, поскольку для его получения в качестве минерала используют нефелин, более редко встречающийся в природе, чем, например, бокситы, что и сказывается на его высокой стоимости.
2.2 Соли железа
Сульфат железа (11) или железный купорос FeSO4*7Н2О. Железный купорос представляет собой прозрачные кристаллы зеленого цвета. Под действием кислорода воздуха двухвалентное железо окисляется в трехвалентное приобретают бурый оттенок. В воде растворяется 265 г./л железного купороса при 20°С.
Растворимость гидроксида железа (II) в воде приведена на рис. 1, из которого видно, что этот коагулянт может применяться при рН > 9–10. Для уменьшения концентрации растворенного гидроксида железа (II) при более низких величинах рН производят окисление двухвалентного железа в трехвалентное. Процесс окисления осуществлять за счет растворенного в воде кислорода: 4FeSO4 + O2 + 2H2O = 4Fe(OH)3.
Для окисления железа может быть использован метод хлорирования. Расход хлора при составляет 0,24 мг на 1 мг FeSO4.
Положительное качество солей железа как коагулянтов – высокая плотность гидроксида (3,6 г/см3), обеспечивающая получение плотных, тяжелых хлопьев оседающих с большой скоростью.
Коагуляция с использованием солей железа неприемлема для сточных вод, содержащих фенолы, так как образующиеся растворимые в воде феноляты железа интенсивно окрашены. Кроме того, гидроксид – железа является катализатором, способствующим окислению некоторых органических веществ и образующим комплексные окрашенные соединения, растворимые в воде.
Хлорид железа(III). FeCI3 * 6Н2O представляет собой темные кристаллы с металлическим блеском, очень гигроскопичен.
С целью повышения эффективности очистки сточных вод предложено использовать коагулянт, состоящий из смеси растворов сульфата алюминия и хлорида железа в соотношении 1: 1 (по массе). Преимущества смешанного коагулянта повышение эффективности очистки воды при низких температурах и улучшение седиментационных свойств хлопьев.
Однако трудности, связанные с хранением и приготовлением коагулянта, а также возможность повышения содержания железа в очищенной воде при нарушениях технологического процесса, ограничивает применение смешанного коагулянта.
2.3 Соли магния
Хлорид магния предложено использовать для очистки сточных вод производства полистирольных пластмасс, а также вод, загрязненных эмульгированными маслами. Очистка производится при рН = 11,0. Растворимость гидроксида магния в воде при 200С – 9 мг/л – плотность – 2,4 г/см3. С. Уменьшением величины рН растворимость гидроксида магния в воде увеличивается.
Использование солей магния позволяет сократить продолжительность хлопьеобразования. Снижение температуры очищаемой воды практически не уменьшает эффективности ее очистки. В качестве коагулянтов могут быть использованы сульфат магния (МgSO4*7Н2О) и хлорид магния (МgС12 * 6Н2О).
Для очистки сточных вод может быть использован известковый шлам с добавлением карбоната магния. При этом происходит осаждёние Мg(ОН)2 и СаСО3. Преимущества этого метода: вода в процессе очистки практически не загрязняется минеральными солями, имеется возможность регенерации Мg из осадка путем обработки его диоксидом углерода образованием растворимого в воде бикарбоната магния который может быть повторно использован[5].
3. Современные новые коагулянты, способы их получения и применения
3.1 Алюмосиликатный раствор
В химической промышленности сточные воды обрабатывают при постоянном перемешивании алюмосиликатным раствором отношением А12: SiO2. В качестве реагента также используют раствор нефелина в 12% серной кислоте или раствор кислой сточной воде с рН 2.2
Этот способ коагуляционной очистки относится к обработки сточных вод химической промышленности от ионов железа, меди, никеля, кобальта, титана, фосфора, алюминия, кремния, кальция, магния, цинка, хрома, марганца, радиоактивных элементов, красителей, коллоидных частиц, органики, шламов, илистых частиц, взвесей, жировых и масляных эмульсий.
Очистка сточных вод от ионов тяжелых металлов проводится путем введения смеси высокодисперсного железа и угольного порошка при массовом отношении компонентов 1:0,05 – 0,1. Однако недостатком способа является необходимость специального приготовления реагентов и недостаточная степень выделения ионов тяжелых металлов из разбавленных растворов.
Применяется очистка от никеля путем введения в раствор каустического магнезита и проведения процесса при температуре 80–85°С. Минусом этой коагуляционной очистки является большой избыток магнезита (в 58–74 раза) по отношению к никелю и необходимость дополнительных энергозатрат при осуществлении процесса [8,9].
