Нуклеофильное замещение у тетраэдрического атома углерода
Аналогичные выводы были сделаны при сравнении скоростей рацемизации и обмена галогена в оптически активных галогенпроизводных (поскольку исходное и конечное соединение идентичны, для изучения скорости процесса использовали радиоактивные галоген-ионы).
Это было показано методом меченых атомов.
Если предположить, что каждый акт обмена сопровождается обращением конфигурации, то при прохождении реакции на 50 % должен образовываться полностью рацемизованный продукт, т. е. скорость обмена должна быть в два раза меньше скорости рацемизации. Экспериментальные данные полностью согласуются с этим предположением. Таким образом, обмен иода в 2-иодоктане идет с полным обращением конфигурации.
В то же время многие реакции нуклеофильного замещения идут с полной потерей оптической активности при каждом акте реакции. Так, реакция сольволиза оптически активного а-хлорбензола в 80%-м водном растворе ацетона сопровождается 97%-й рацемизацией:
Кинетический характер реакций нуклеофильного замещения
Наиболее часто реакции нуклеофильного замещения описываются одним из двух кинетических уравнений.
Реакция может описываться уравнением первого порядка. этом случае скорость процесса не зависит ни от концентрации, ни от природы нуклеофила.
Такое кинетическое уравнение свидетельствует о том, что' нуклеофил не принимает участия в скоростьопределяющей стадии процесса и предшествующих ей предравновесных стадиях. В то же время изменение соотношения образующихся продуктов при использовании смесей нуклеофилов и при варьировании их концентраций является доказательством того, что нуклеофил участвует в реакции на быстрой стадии, следующей за скорость-определяющей.
Во втором случае реакция имеет суммарный второй порядок и первый порядок по субстрату, так и по нуклеофилу.
Для этих реакций характерна высокая зависимость скорости процесса от природы нуклеофила.
5.SN1 и SN2 реакции.
Основополагающий вклад в изучение реакций замещения у sp3-гибридизованного атома углерода внес Ингольд. Классическим примером реакции нуклеофильного замещения является превращение алкилгалогенида в спирт:
R-Cl + HO- --> R-OH + Cl-
При изучении кинетики реакций такого типа было установлено, что они могут протекать по двум механизмам (мономолекулярное и бимолекулярное замещение), которым отвечают кинетические зависимости:
V1=k’[R-Hal] (SN1)
V2= k[R-Hal][HO-] (SN2)
Обозначение реакций (SN1) и (SN2) было также предложено Ингольдом и расшифровывается, соответственно, как нуклеофильное замещение мономолекулярное и бимолекулярное (от англ. Substitution nucleophilic).
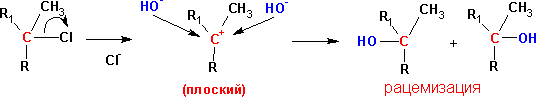
МОНОМОЛЕКУЛЯРНОЕ НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ (SN1)
БИМОЛЕКУЛЯРНОЕ НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ (SN2)
Предполагается, что реакция протекает по следующей схеме: 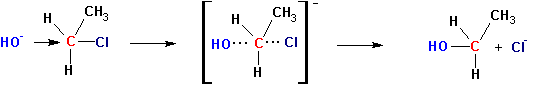
Если в исходном соединении существовала какая-нибудь оптическая конфигурация (D-, L- ), то в результате реакции происходит ее обращение (L-, D-).
В реакции этого типа преимущественно вступают пространственно незатрудненные первичныеалкилгалогениды, при отщеплении уходящей группы от которых не образуется стабилизированного карбкатиона.
6.ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ У НАСЫЩЕННОГО АТОМА УГЛЕРОДА
|
Факторы |
(SN1) |
(SN2) |
|
Строение субстрата |
Реакционная способность падает в ряду: Бензильный, аллильный > третичный > вторичный > первичный |
Реакционная способность растет в ряду: Бензильный, аллильный < третичный < вторичный < первичный |
|
Вступающая группа |
Практически нет влияния |
Чем больше нуклеофильность, тем вероятнее протекание реакции |
|
Уходящая группа |
Чем ниже энергия связи, тем легче протекает реакция |
Замещение затрудняется с увеличением нуклеофильности (основности) уходящей группы |
|
Стерические факторы |
Увеличение числа алкильных заместителей и электронодонорных групп у нуклеофильного центра способствует протеканию реакции. |
Препятствуют атаке нуклеофильного центра и затрудняют реакцию |
|
Влияние растворителя |
Реакции способствуют протонные полярные растворители |
Влияние растворителя сказывается значительно меньше, но реакцию затрудняют растворители, сольватирующие нуклеофил. В целом, лучше протекают с апротонными полярными растворителя. |
|
Концентрация нуклеофила |
На скорость реакции не влияет |
Скорость реакции пропорциональна концентрации нуклеофила |
7.Применение реакций нуклеофильного замещения
При помощи этих реакций нуклеофильного замещения может быть замещено большое количество различных групп. Баннетт и Цейлер [68] дали следующий приблизительный порядок легкости замещения групп: _ F> —N02 > —Cl, —Br, — J > —OS02R > — NRt> - OAr > -— OR > - SR, SAr > - S02 R > - NR2.
Значительно менее удовлетворительное положение в отношении свободно-радикального и нуклеофильного замещения. В случаях свободно-радикального замещения доказано существование п- и сг-комплексов, они, по-видимому, участвуют в механизме замещения в ароматических соединениях. Однако отсутствуют пока определенные данные о существовании и стойкости этих промежуточных соединений и сравнительно мало можно сказать о деталях интимного механизма свободно-радикального замещения. В случаях нуклеофильного замещения положение еще менее удовлетворительно, поскольку дело касается замещения «неактивированных» ароматических соединений. В, настоящее время невозможно дать достаточно обоснованного объяснения замещениям этого типа.
В присутствии галоидов или подобных им электроотрицательных заместителей в кольце становится возможной вся область реакций нуклеофильного замещения, которые не идут с самими исходными углеводородами. Эти реакции замещения распадаются, естественно, на два различных класса: 1) класс, включающий замещение «иеактивированных», и 2) класс реакций, в которых замещению подвергается «активированный» заместитель.
