О растворах
Растворы – это твердые или жидкие гомогенные системы переменного состава, состоящие из двух или более компонентов.
Любой раствор состоит из растворённого вещества и растворителя.
Растворитель – это компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. Например, в водном растворе глюкозы растворителем является вода, а глюкоза – растворённое вещество).
В растворах электролитов всегда электролиты считаются растворёнными веществами.
Классификация растворов.
I. По агрегатному состоянию различают газовые, жидкие и твёрдые растворы. Но обычно термин растворы относится к жидким системам.
II. В зависимости от молярной массы растворенного вещества различают растворы низкомолекулярных соединений и растворы высокомолекулярных соединений:
1) растворы низкомолекулярных соединений (НМС) – молярная масса менее 5000 г./моль;
По наличию или отсутствию электролитической диссоциации растворы НМС делят на 2 класса:
· растворы электролитов – это растворы веществ, которые диссоциируют на ионы – солей, кислот, оснований. Например, растворы NaCl, HCl, KOH.
· растворы неэлектролитов – это растворы веществ, которые практически не диссоциируют на ионы. Например, растворы глюкозы, сахарозы, мочевины.
2) растворы высокомолекулярных соединений (ВМС) – молярная масса более 5000 г./моль.
Большинство ВМС – полимеры, макромолекулы которых состоят из большого числа повторяющихся мономерных звеньев.
1. Термодинамика процессов растворения
Растворение – это физико-химический процесс. При растворении идут как физические процессы (диффузия), так и химические (сольватация – образование химических связей между частицами растворяемого вещества и растворителя). Если растворителем является вода, то процесс называется гидратацией.
Согласно 2-му закону термодинамики при р=const и Т=const вещества самопроизвольно будут растворяться, если энергия Гиббса системы будет при этом понижаться, т.е. ![]() G = (
G = (![]() H – T
H – T![]() S) < 0.
S) < 0.
Величина ![]() H называется энтальпийным фактором растворения.
H называется энтальпийным фактором растворения.
Величина T![]() S называется энтропийным фактором растворения.
S называется энтропийным фактором растворения.
При растворении твердых и жидких веществ энтропия системы обычно возрастает (![]() S >0); при растворении газов энтропия системы обычно уменьшается (
S >0); при растворении газов энтропия системы обычно уменьшается (![]() S <0).
S <0).
Энтальпия при растворении может как увеличиваться (NaCl), так и уменьшаться (KOH).
Таким образом, образование растворов (в отличие от механических смесей) сопровождается изменением энтальпии, энтропии и объёма системы.
3. Способы выражения концентрации растворов
Концентрация является важной характеристикой раствора. Концентрация определяет относительное содержание компонентов в растворе.
Массовая доля равна отношению массы растворённого вещества к массе раствора:
![]()
Молярная концентрация – это количество вещества, содержащееся в одном литре раствора (моль/л):
![]()
![]()
Молярная концентрация эквивалента (нормальная концентрация) – это число молей эквивалентов вещества, содержащихся в одном литре раствора (моль/л):
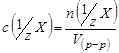 , где
, где
![]() - количество вещества эквивалента (моль);
- количество вещества эквивалента (моль);
![]() - фактор эквивалентности;
- фактор эквивалентности;
V(р-ра) – объём раствора (л).
Эквивалент – это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода, а в окислительно-восстановительной эквивалентна одному электрону.
Фактор эквивалентности ![]()
![]() – число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
– число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
Фактор эквивалентности рассчитывают на основе стехиометрии данной реакции из равенства
![]()
где z – основность кислоты или кислотность основания данной кислотно-основной реакции, а также число электронов, присоединяемых или теряемых частицей в данной окислительно-восстановительной реакции.
Молярной массой эквивалента вещества Х называют величину, измеряемую произведением фактора эквивалентности на молярную массу вещества Х
![]()
где ![]() - молярная масса эквивалента.
- молярная масса эквивалента.
Молярная масса эквивалента вещества – это масса одного моль эквивалентов. В разных реакциях одно и тоже вещество может иметь разные эквиваленты.
Моляльная концентрация – это количество вещества, содержащееся в одном килограмме растворителя (моль/кг):
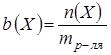
Молярная доля равна отношению количества растворённого вещества к общему количеству веществ в растворе:
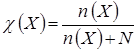
Как правило, вещество обладает определённой растворимостью в данном растворителе. Под растворимостью понимают концентрацию вещества в насыщенном растворе.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Насыщенный раствор может как угодно долго находиться в равновесии с избытком растворяемого вещества (ΔGр−ния = 0), и его концентрация имеет максимально возможное в данных условиях значение.
4. Электролиты. Коллигативные свойства растворов электролитов
Электролиты – это вещества, растворы которых проводят электрический ток посредством ионов, на которые они распадаются под действием полярных молекул растворителя.
Количественной характеристикой диссоциации электролита является степень диссоциации ![]() , которая равна отношению числа продиссоциировавших молекул к общему числу молекул:
, которая равна отношению числа продиссоциировавших молекул к общему числу молекул:
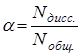
По степени диссоциации различают сильные электролиты ![]() слабые электролиты
слабые электролиты ![]() и электролиты средней силы
и электролиты средней силы ![]()
