Определение содержания аскорбиновой кислоты в яблоках различных сортов
Приготовление хингидрона.
100 г железных квасцов растворяют в 300 мл воды при 65о этот раствор выливают в раствор 25 г гидрохинона в 300 мл воды. Кристаллы хингидрона осаждаются в виде тонких игл. После охлаждения льдом их отсасывают. Выход 15 г. После перекристаллизации из воды этот хингидрон содержит только следы железа.
Ход определения.
Для приготовления вытяжек берут навеску муки семян 10 г и смешивают с 100 мл хорошо прокипяченной дистилированной воды. После часа стояния хорошо взбалтывают, дают отстояться и набирают пипеткой с обрезанным или оплавленным кончиком, в который вставлен плотный тампон (для фильтрования), несколько миллилитров экстракта. Листья, плоды, клубни измельчают на мясорубку (иногда два раза) и указанной выше пипеткой отбирают 20 – 30 мл сока. Удобно бывает предварительно отжать мезгу. Раствор или сок наливают в химический стакан на 50 – 100 мл (удобнее пользоваться пробиркой с конусовидным дном), насыпают в него щепотку хингидрона (чтобы после взбалтывания оставался осадок), опускают в него вычищенный платиновый электрод, который соединен с подвижным контактомю Измеряемый элемент состоит из двух электродов стандартного полуэлемента, соединенного с исследуемым электродом (раствором, соком), в который прибавлено немного кристаллов хингидрона (хингидронный электрод). В этот же стакан вставляют дугообразную трубку, наполненную раствором хлористого калия и агар-агара в воде. Другой конец ее опущен в промежуточный сосуд с насыщенным раствором хлористого калия; в этот сосуд опущен каломелевый электрод (малая цепь). После этого включают цепь и при помощи подвижного контакта находят нулевое положение контакта на линейке. Затем включают в малую цепь нормальный элемент Вестона и находят нулевое положение, передвигая для этого скользящий контакт.
Так как электродвижущая сила элемента Вестона известна, то ЭДС испытуемого хингидронно-каломелевого элемента находят по формуле
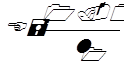 при 18 градусах Цельсия,
при 18 градусах Цельсия,
где l – отсчет длины отрезка по линейке при включении в цепь испытуемого элемента (сок, вытяжка), l1 – отсчет при включении элемента Вестона.
Повторив определение с новой порцией раствора, берут среднее и вычисляют рН по формуле:
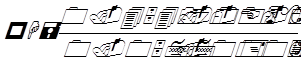 ,где
,где
0.00068(t-18) и 0.0002(t-18) являются температурными поправками.
Сильнокислая среда – рН 0 – 3, слабокисла – рН 4 – 6, слабощелочная – рН 8 – 10, сильнощелочная – рН 11 – 14, нейтральная – рН 7.
Принципы измерения с двумя реостатами (магазинами сопротивлений). Вместо измерительной линейки удобной пользоваться установками с магазинами сопротивлений. В большой круг (рис. ) включены реостаты 1 и 2 на 1000 или 1100 Ом каждый, в малый круг – реостат 2. В реостате 1 все ключи сняты, следовательно включено 1000 Ом, а в реостате 2 все ключи в своих гнездах, и ток через реостат проходит без сопротивления. Если же из реостата 2 мы переставим ключи в соответствующие места реостата 1, то этим введем сопротивление в малом круге цепи, не изменив общего сопротивления в большом круге цепи.
Ход определения сводится к тому, чтобы довести сопротивление в малой цепи до компенсации тока в большой цепи. Для этого в малой цепи при включенном стандартном элементе увеличивают сопротивление путем перестановки ключей из реостата 2 в такие же гнезда реостата 1 (включая на мгновение гальванометр). Ключи подбирают до тех пор, пока гальванометр не покажет отсутствие тока. Тогда подсчитывают введенные сопротивления, суммируя сопротивления (в омах) в магазине 2, и записывают. Затем включают испытуемый каломельно-хингидронный электрод и точно таким же образом достигают полной компенсации тока перестановкой ключей. Подсчитав, записывают новое сопротивление в магазине 2. По формуле узнают ЭДС испытуемого элемента:
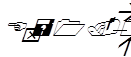 ,
,
где а – сопротивление в омах при включении испытуемого раствора, б – сопротивление при включении нормального элемента, Е – электродвижущая сила в вольтах. Упрощенная формула:
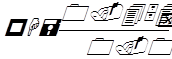 ,
,
где 0.4541 – разность потенциалов хингидронного и насыщенного каломелевого электрода.
В цепи, где разность потенциалов между раствором и металлом определяется водородными ионами, одной единице рН соответствует потенциал около 58 мВ (0.058 В).
2.5н NaOH – 0.05 н
5 мл NaOH – 245 мл H2O
Vhcl (0.1000) = 5мл (v naoh = 10.6, 10.7)
Навеска ябл.
зел – 2г. титровалось 2.6, 2.6
кр – 2г титровалось 3.6, 3.7
