Определение стабильной и обменной емкости цеолитсодержащей породы Атяшевского проявления
Количество поглощенных ионов, соответствующее полному насыщению, когда проскок равен 1, соответствующее сумме ДОЕ и площади заштрихованной фигуры над S -образной кривой, называют полной динамической обменной емкостью (ПДОЕ). В типовых процессах водоподготовки ДОЕ обычно не превышает 0,4–0,7 ПОЕ.
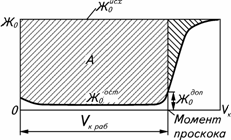
Рис. 1 - Сравнение полной динамической ПДОЕ и динамической обменной емкости ДОЕ. Заштрихованная площадь А соответствует ДОЕ, а вся площадь над кривой с учетом проскока солей – ПДОЕ
3. Экспериментальная часть
Реагенты и растворы: соли MgCl2*6H2O в дистиллированной воде в мерной колбе ёмкостью 250 смЗ
Раствор 1 нитрата кальция (0.02М) готовили растворением навески (1.18 г.) соли Са(NО3)2·4Н20. После растворения навески раствор разбавили в дистиллированной воде в мерной колбе ёмкостью 250 смЗ.
Раствор 2 нитрата кальция (О.1М) готовили растворением навески (5.09г.) соли Са(NО3)2·4Н20. После растворения навески раствор разбавили в дистиллированной воде в мерной колбе ёмкостью 250 смЗ.
Исходный раствор комплексона III готовили из фиксанала. Стандартизацию проводили по сульфату магния.
Буферные растворы готовили из NH4Cl “ч.д.а.” и NH4OH.
Остаточную концентрацию ионов Mg2+ определяли комплексонометрически с индикатором эриохромом черным Т.
Остаточную концентрацию ионов Ca2+ определяли комплексонометрически с индикатором мурексидом.
Сорбированную концентрацию находили по разности между исходной и остаточной.
В качестве сорбента использовали цеолитсодержащую породу Атяшевского проявления.
Приготовление сорбента.
ЦСП Атяшевского проявления дробили, просеивали, собирали фракции гранул размером 1 - 2 - 3 мм и просушивали в сушильном шкафу.
Ионообменная емкость в статическом режиме. К 20 смЗ раствора, содержащего ионы Ca2+ ,в другом случае Mg2+ ,с известной концентрацией и
определённым значением рН прибавляли 5.0 г сорбента, встряхивали в течение заданного времени и отделяли твёрдую фазу фильтрованием. В
Селективность хелатометрического титрования в отношении кальция можно повысить, проводя определение в сильнощелочной среде (магний фильтрате определили остаточную концентрацию ионов Ca2+ ,в другом случае Mg2+ .Сорбированную концентрацию находили по разности между исходной и остаточной.
Металлохромного индикатора - мурексид.
Содержание магния определяли титруя смесь в аммиачном буферном растворе по индикатору эриохром чёрному Т (1), затем определяли содержание кальция, титруя раствор при рН > 11 по индикатору мурексиду
ЭДТА, 0.05М раствор; аммиачная буферная смесь рН=9; NaOH, 2М раствор; индикаторы - эриохром чёрный Т И мурексид - твёрдые (смесь с NaCl в отношении 1: 100).
Методика определения
1. Пробу анализируемого раствора переносили в колбу для титрования, добавляли 10см3 аммиачной буферной смеси (рН 9), 25 см3 дистиллированной воды, на кончике шпателя 30 - 40 мг эриохром чёрного Т И перевешивали систему до полного растворения индикатора. Раствор приобрёл вино-красный цвет. Титрование раствором ЭДТА проводили по каплям из бюретки при непрерывном перемешивании до изменения окраски в четко синюю.
2. Пробу анализируемого раствора переносили в колбу для титрования, добавляли 5 см3 2М раствора NaOH, 30 см3 дистиллированной воды и на кончике шпателя 30 мг мурексида. Раствор приобрёл красный цвет. Титрование проводили раствором ЭДТА до перехода окраски в фиолетовую.
Вычисление статистических условиях по отношению к ионам кальция и магния.
Определение обменной ёмкости по магнию
К 20 см3 раствора хлорида магния с молярной концентрацией эквивалента 0.02 моль/л прибавил и 5,0г сорбента, предварительно просушенного при 1050С в течение 1 часа и встряхивали в течение заданного времени (0.5 часа). В другом случае 1 час и так далее. По истечении времени раствор отфильтровали. Брали на анализ 5 см3 фильтрата и определяли остаточную концентрацию ионов Mg2+ комплексонометрическим методом.
2. К 20 см3 раствора хлорида кальция с молярной концентрацией эквивалента 0,l моль/л прибавили 5.0 г сорбента, предварительно просушенного при 1050C в течение 1 часа и встряхивали в течение заданного времени (0.5 часа). В другом случае 1 час и так далее. По истечении времени раствор отфильтровали. Брали на анализ 5 см3 фильтрата и определяли остаточную концентрацию ионов Ca2+ комплексонометрическим методом.
Влияние времени контакта ЦСП и раствора CaCl2 • 4Н2О на обменную ёмкость ЦСП в статических условиях.
|
№ |
Время |
Концентрация ионов Са2+ моль/л | ||
|
пробы |
контакта |
СОЕ, | ||
|
п/п |
фаз,час |
Остаточная |
Сорбированная |
Моль*экв/г |
|
1 |
0,5 |
0,052+0,01 |
0,048+0,0013 | |
|
2 |
1 |
0,064+0,016 |
0,036+0,0011 | |
|
3 |
2 |
0,075+0,002 |
0,025+0,016 | |
|
4 |
3 |
0,075+0,0105 |
0,025+0,00106 | |
(С(Са2+)исх = 0.1 моль/л;mцсп = 5.0 г.)
При увеличении времени контакта фаз наблюдается увеличение равновесной концентрации. А по истечении 3 часов устанавливается динамическое подвижное равновесие.
Литература
1. Жданов С.П. Химия цеолитов / С.П. Жданов, Е.Н. Егорова. - Л.: Наука, 1968. - 158 с.
2. Челищев Н.Ф. Цеолит - новый тип минерального сырья / Н.Ф. Челищев, Б.Г. Беренштейн, В.Ф. Володин. - М.: Недра, 1987. - 176 с.
3. Челищев Н.Ф. Кинетика ионного обмена щелочных и щелочноземельных металлов на природном клиноптилолите / Н.Ф. Челищев, В.Ф. Володин - М.: Геохимия, 1976. - N212 - с. 160.
4. Ионообменные свойства клиноптилолита / Н.Ф. Челищев, Б.Г. БеренштеЙн, Т.А. Беренште и др. - Докл. 1973. - Т.210. - N2 5. С.III0-1112.
5. Сунин А.Н. Методические указания к практикуму по количественному анализу. / А.Н. Сунин, А.А. Седова, А.А. Рыбкина. - Саранск: Изд-во Мордов. Ун-та. 1998.
6. Ушакова Н.Н., Николаева Е.Р., Моросанова С.А. Пособие по аналитической химии. - М.: Наука, 1974.
7. Золотов Ю.А. Основы аналитической химии. Учебник для вузов / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева. - 2-е изд., перераб. и доп. М.: Высш. шк., 2002.
