Первое начало термодинамики и его применение
В соответствии с уравнениями (II, 17) и (II, 20) тепловой эффект химической реакции при постоянном объеме Qv равен приращению внутренней энергии системы во время реакции; тепловой эффект химической реакции при постоянном давлении Qp равен приращению энтальпии во время этой реакции:
QV = ΔU, Qn= ΔH. (II, 22)
При этом тепловой эффект эндотермической реакции, т. е. реакции, протекающей с поглощением тепла, в соответствии с общими правилами знаков для переданной теплоты будет положительным; а тепловой эффект экзотермической реакции, т. е. реакции, протекающей с выделением тепла, — отрицательным. В дальнейшем изложении тепловой эффект химической реакции при постоянном объеме будет обозначаться AU и при постоянном давлении — ΔН.
Из (II, 19) для процесса, протекающего при р = const, вытекает соотношение
ΔH = ΔU + pΔv. (П.23)
Для химической реакции из уравнений (И, 23) и (II, 15) получаем
ΔH=ΔU + ΔnRT, (II, 24)
где An — приращение числа молей газообразных веществ в результате протекания химической реакции.
Из уравнения (II, 24) можно вычислить тепловой эффект реакции ΔН, если известен тепловой эффект ΔU.
Если реакция происходит в конденсированных фазах, т. е. когда реагенты представляют собой жидкие и твердые продукты, то различием между АН и AU можно пренебречь.
При написании уравнений термохимических реакций указывают агрегатное состояние реагентов и тепловой эффект реакции. Так, например,
РС15 (т) + Н20 (г) -> РОС13 (ж) + 2НС1 (г) ΔН = — 111,4 кдж.
Это означает, что тепловой эффект данной реакции при постоянном давлении равен ΔH = 111,4 кдж.
Поясним на примере окисления железа приемы использования первого начала термодинамики (закона Гесса) при расчете тепловых эффектов реакций.
Железо, реагируя с кислородом, может образовать окись железа (III):
2Fe (т) +1,502 (г) -> Fe203 (т) ΔН1=821 кдж. (1)
Эта же реакция может осуществляться другим путем с образованием промежуточного продукта — окиси железа (II):
2Fe (т) + О, (г) 2FeO (т) ΔH2 = 527 кдж; (2)
2FeO (т) +0,502(г) -> Fe203 (т) ΔH3 = — 294 кдж. (3)
Все три реакции протекают при постоянном давлении, причем начальные и соответственно конечные состояния (температура, агрегатное состояние и др.) для реакций (1) — (3) одинаковы.
При помощи закона Гесса можно определить тепловой эффект одной из этих реакций [например, реакции (1)], если известны тепловые эффекты двух других реакций. Для этого используются два приема.
1. Прием алгебраического сложения термохимических уравнений. После алгебраического суммирования уравнений реакций (2) и (3) и сокращения одинаковых слагаемых получим
2Fe (т)+1,50., (г) -> Fe203 (т) ДЯ2 + АН3.
Как видно, термохимическое уравнение (4) совпадает с (1). Отсюда в соответствии с законом Гесса получаем
ΔH1 = ΔH2 + ΔH3,
или
— 527+ (— 294) = —821 кдж, что совпадает со значением ΔН=-821 кдж.
Термохимия
Большое значение для термохимии имеет закон Гесса, так как при помощи его можно рассчитывать тепловые эффекты таких реакций, которые или нереализуемы, или не могут быть проведены до конца. Закон Гесса позволяет вычислять тепловые эффекты процессов, для которых экспериментальные данные отсутствуют. Это относится не только к химическим реакциям, но и к процессам растворения, испарения, сублимации, кристаллизации и др.
Тепловые эффекты химических реакций можно вычислить по теплотам образования и сгорания.
Теплотой образования называют тепловой эффект при образовании из простых веществ одного моля соединения. При этом теплота образования простых веществ (N2, Н2, 02 и др.) принимается равной нулю. Стандартные теплоты образования вычисляются при стандартных условиях: 25°С и 1,013-105 н/м2 (1 атм). Простые вещества рассматриваются в том агрегатном состоянии и в той модификации, в каких они устойчивы при стандартных условиях. Например, стандартная теплота образования карбоната кальция — это тепловой эффект реакции
Са(т) + С(граф)+1,502(г) = СаС03(т) ΔH = — 1206 кдж.
По сравнительно небольшому числу стандартных теплот образования можно вычислить тепловые эффекты многих химических реакций. При этом пользуются правилом, которое вытекает из закона Гесса: тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ. В математической форме это правило записывается следующим образом:
![]() (II, 25)
(II, 25)
Если известен тепловой эффект реакции ΔН, то тепловой эффект ΔU вычисляется по (II, 24).
Зная тепловой эффект образования химического соединения в одном агрегатном состоянии, можно на основе закона Гесса вычислить тепловой эффект его образования в другом агрегатном состоянии:
![]()
При термохимических расчетах реакций, протекающих в растворах, надо учитывать тепловой эффект процесса растворения химического соединения в данном растворителе.
Тепловой эффект образования химического соединения, диссоциирующего на ионы, определяется по теплотам образования ионов в растворе.
Теплота растворения зависит от концентрации химического соединения в растворе. Теплота, которая поглощается или выделяется при растворении одного моля вещества в таком количестве растворителя, чтобы образовался раствор с определенной моляльностыо т, называется интегральной теплотой растворения.
Теплота растворения твердого соединения с ионной кристаллической решеткой определяется в основном суммой двух величин: теплоты разрушения кристаллической решетки и теплоты сольватации ионов молекулами растворителя. В связи с тем, что на разрушение кристалла теплота затрачивается, а процесс сольватации сопровождается выделением теплоты, знак теплоты растворения может оказаться как положительным, так и отрицательным в зависимости от того, какое из двух слагаемых больше по абсолютной величине. Например, при растворении 1 моль СиС12*2Н20 в 8 моль воды поглощается 3,35 кдж теплоты; при растворении того же количества кристаллогидрата в 12 моль воды теплота растворения равна нулю; а при его растворении в очень большом количестве воды выделяется 17,67 кдж теплоты.
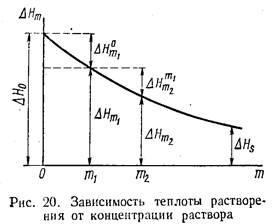
Зависимость интегральной теплоты растворения ΔНт от моляльности т раствора приведена на рис. 20. Значение ΔH равно первой интегральной теплоте растворения; оно равно тепловому эффекту при растворении одного моля вещества в бесконечно большом количестве растворителя; А Н0 определяется графической экстраполяцией ΔHт к т = 0. Отрезок ΔНя на рис. 20 соответствует последней или полной интегральной теплоте растворения; она равна теплоте растворения моля вещества в таком количестве растворителя, чтобы образовался насыщенный раствор.
