Подгруппа углерода
Ход работы: В две пробирки наливают до половины раствор серной кислоты. В первую пробирку помещают 1/3 таблетки уротропина и, помешивая, растворяют ее. Вторая пробирка – контрольная. В каждую пробирку опустить по хорошо очищенному железному гвоздю. В пробирке с ингибитором начавшееся выделение водорода быстро прекращается. В контрольной пробирке водород выделяется энергично.
Утилизация. Растворы использовать многократно.
Опыт № 7. Защита от коррозии покрытием оксидной пленкой
Оборудование и реактивы: Штатив с пробирками, железный гвоздь, концентрированная азотная кислота (ρ=1,48 г/см3), пинцет, раствор серной кислоты (1:5), спирт, вата, наждачная бумага.
Ход работы: Тщательно очищенный наждачной бумагой и обезжиренный спиртом гвоздь помещают на 1-2 мин. в пробирку с холодной концентрированной азотной кислотой. За это время железо пассивируется - покрывается тонким слоем из оксидов железа. Гвоздь промывают в воде и опускают в раствор серной кислоты. Выделение водорода не наблюдается. Для контроля в раствор серной кислоты опускают гвоздь, не обработанный концентрированной азотной кислотой. Происходит выделение водорода.
Техника безопасности. Наливать концентрированную азотную кислоту в пробирку под тягой.
Утилизация. По окончании опыта слить кислоты в соответствующие емкости и использовать многократно.
Опыт № 8. Катодная защита металлов от коррозии
Оборудование и реактивы: Выпрямитель, штатив с лапкой, прокладки резиновые, стакан, U-образная трубка, железные стержни, наждачная бумага, 1 % раствор серной кислоты, разбавленный раствор красной кровяной соли.
Ход работы: В U-образную трубку наливают 1 % раствор серной кислоты с добавкой красной кровяной соли до слабо желтой окраски. Опускают в каждое колено трубки железные стержни – электроды и подсоединяют их к источнику постоянного тока при напряжении 10-12 В. Быстрое посинение наблюдается у стержня, соединенного с положительным полюсом источника тока. А железный стержень, соединенный с отрицательным полюсом (катодом), предохраняется от коррозии (отсутствует или слабо представлена синяя окраска). Объяснить наблюдаемые явления, выразить процессы уравнениями реакций.
Техника безопасности. С электроприбором работать, не касаясь оголенных проводников.
Утилизация. Раствор из U-образной трубки слить в нейтрализатор.
Опыт № 9. Коррозия железа
Оборудование и реактивы: 5 стаканов на 50 мл, 5 лабораторных пробирок, 5 железных гвоздей, вода дистиллированная, раствор хлорида натрия, раствор гидроксида натрия, медная и цинковая проволока.
Ход работы: Поместить железный гвоздь в пробирку, наполнить ее доверху водой и опрокинуть в стакан с водой. Таким же образом заготовить другие пробирки с гвоздями, но в место чистой воды в пробирки и в сосуды, в которые они будут опрокинуты, налить раствор хлорида натрия. В одном случае к этому раствору добавить немного раствора гидроксида натрия. К одному гвоздю заранее прикрепить медную проволоку, к другому - полоску или проволоку цинка. Примерно через сутки наблюдать процесс коррозии железного гвоздя и цинковой полоски. Объяснить наблюдаемые явления. Сравнить результаты опытов. Написать уравнения реакций.
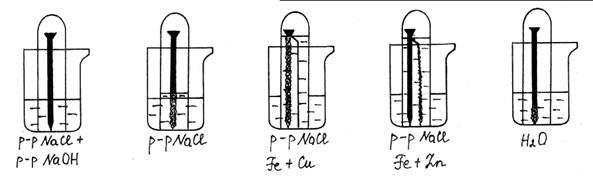
Рис. 31. Электрохимическая коррозия железа.
Утилизация. Все растворы из стаканов сливают в раковину, кроме раствора с соединениями цинка, который помещают в нейтрализатор.
ЛАБОРАТОРНАЯ РАБОТА № 3
ТЕМА: “МЕТАЛЛЫ ГЛАВНЫХ ПОДГРУПП I-III ГРУПП”
Опыт № 1. Горение кальция
Оборудование и реактивы: Плоскогубцы, фильтровальная бумага, спиртовка, спички, напильник, кальций.
Ход работы: Взять кальций плоскогубцами и очистить его при помощи фильтровальной бумаги от масла. Зажечь спиртовку. В правую руку взять напильник и сделать несколько надрезов по кусочку кальция прямо над пламенем спиртовки. Порошок кальция горит, ярко вспыхивая: 2Ca + O2 ® 2CaO.
Техника безопасности. По окончании опыта напильник и все остатки после очистки кальция поместить в кристаллизатор с водой.
Опыт № 2 . Взаимодействие оксида кальция с водой
Оборудование и реактивы: Химический стакан, воронка, оксид кальция, вода дистиллированная.
Ход работы: Кусочки заранее прокаленного и охлажденного оксида кальция поместить на дно химического стакана. Закрыть стакан воронкой и прилить воду. Идет бурная экзотермическая реакция. По окончании взаимодействия в стакан добавляют несколько капель раствора фенолфталеина.
Техника безопасности. Реакция экзотермическая, сопровождается сильным разогреванием раствора, возможно разбрызгивание горячей щелочи. Поэтому воду в стакан приливают через воронку: CaO + H2O ® Ca (OH)2 + Q.
Утилизация. Поместить щелочной раствор в емкость–нейтрализатор.
Опыт № 3. Качественные реакции на ионы калия, натрия, бария, кальция
Оборудование и реактивы: Спиртовка, спички, пробка со вставленной в нее спиралью от электроплитки, кристаллические хлорид калия, натрия, кальция, бария, раствор соляной кислоты (1:1).
Ход работы: Спираль обрабатывают раствором соляной кислоты. Затем вносят спираль в пламя спиртовки и держат до полного выгорания примесей. Вносят спираль в кристаллическую соль, захватывают спиралью кристаллы соли и вносят в пламя спиртовки. Пламя окрашивается в различные цвета: катион калия дает фиолетовый цвет, катион натрия – желтый, катион кальция – красный, катион бария – зеленый. Использовать для каждого анализа чистую нихромовую спираль.
Техника безопасности. Соблюдать правила работы со спиртовкой, выполнять действия в вытяжном шкафу.
Опыт № 4. Устранение жесткости воды
Оборудование и реактивы: Пробирки, спиртовка, спички, пробиркодержатель, вода дистиллированная, разбавленный раствор соды (5-10%), известковая вода, кристаллические хлориды кальция и магния, жесткая вода.
Для приготовления воды с постоянной жесткостью необходимо в дистиллированной воде растворить хлориды кальция и магния или любые другие соли кальция и магния (примерно, 1% растворы).
Воду с временной жесткостью готовят так: через свежеприготовленную и прозрачную известковую воду пропускают углекислый газ до полного растворения выпавшего осадка карбоната кальция. В растворе будет содержаться гидрокарбонат кальция. Этот раствор готовят непосредственно перед демонстрацией опытов.
Ход работы: Устранение карбонатной (временной) жесткости:
а) кипячение, катионы кальция осаждается в виде карбоната:
Ca2+ + 2HCO3- ® CaCO3¯ + H2O + CO2.
б) добавление известковой воды:
Ca (HCO3)2 + Ca(OH)2 ® 2CaCO3¯ + 2 H2O.
Устранение некарбонатной жесткости. Добавить к жесткой воде раствор соды:
CaCl2 + Na2CO3 ® CaCO3¯ + 2 NaCl;
MgSO4 + Na2CO3 ® MgCO3¯ + Na2SO4.
Рассмотреть другие способы устранения жесткости воды. Выразить процессы уравнениями реакций.
Техника безопасности. При кипячении жесткой воды: а) сначала осторожно прогреть всю пробирку, б) затем прогреть всю воду, но не до кипения, в) довести до кипения верхнюю часть жидкости. Отверстие пробирки направить в сторону от себя и учеников. Все растворы слить в раковину, в них нет токсичных веществ.
