Поиск новых фторидофосфатов лития и переходных металлов
При десяти циклах заряд (4,2 В) - разряд (3,5 В) начальная удельная разрядная емкость 145 A*час/кг. Потери разрядной удельной емкости 0,1% на 1 цикл [5].
К недостаткам кобальтита лития относят то, что при многократном циклировании часть ионов кобальта перемещается в литевые слои, слоистая структура перестраивается в каркасную типа шпинели, и движение ионов лития затрудняется, а также высокую стоимость и токсичность [2].
Поэтому ведутся интенсивные поиски и исследования альтернативных материалов. В частности, большое число работ посвящено легированию LiCoO2, структурно родственным ему соединениям LiMnO2, LiNiO2 , фазам типа шпинели на основе LiMn2O4 и др. В частности, хорошо зарекомендовали себя фазы типа оливина LiMPO4 (где M = Mn, Fe, Co, Ni), описываемые ниже.
1.2. Смешанные фосфаты лития и переходных металлов
Двойные фосфаты, имеющие общую формулу LiMPO4 (где M = Mn, Fe, Co, Ni), изоструктурны оливину - силикату магния и железа (Mg,Fe)2SiO4.
Таблица 1
Параметры решетки и разрядные характеристики соединений LiMPO4 [6- 9]
|
M |
a, Å |
b, Å |
c, Å |
U, В |
Емкость, А*час/кг |
|
Mn |
10,45 |
6,11 |
4,75 |
4,1 |
140 |
|
Fe |
10,31 |
6,00 |
4,69 |
4,3 |
148 |
|
Co |
10,20 |
5,92 |
4,68 |
4,8 |
86 |
|
Ni |
10,20 |
5,92 |
4,68 |
Фосфаты LiMPO4, где M = Mn, Co, Ni получены в ходе взаимодействия карбоната лития, оксида металла (MO или MnO2) и дигидрофосфата аммония - (NH4)2HPO4 при температуре 350 °C, которую затем повышали до 780 °C и выдерживали 18 часов на воздухе [6]. LiFePO4 получен аналогично, но в инертной атмосфере [10].
1.3. Смешанные фторидофосфаты щелочных и переходных металлов
Просмотр реферативных журналов, баз данных PDF-2 и ICSD обнаружил только три фазы формульного типа A+2MPO4F, из них с литием только одна: Li2NiPO4F [11]. Известны также Na2MnPO4F [12], Na2MgPO4F [13], Na4,6FeP2O8,6F0,4 [14, 15, 16, 17].
Структура Li2NiPO4F(рис. 1) определена рентгенографически на монокристалле [11]. Она относится к ромбической сингонии (пространственная группа Pnma, параметры a = 10.473(3) Å, b = 6.2887(8) Å, c = 10.846(1) Å, Z=8). В структуре можно выделить рутиловые цепи из октаэдров NiO4F2, соединенных ребрами, вытянутые вдоль оси y. Эти цепи соединены в двух остальных измерениях тетраэдрами PO4. В пустотах каркаса размещаются катионы лития. Половина их находится в уплощенных тетраэдрах из четырех атомов кислорода, четверть – в квадратных пирамидах из 4 O + 1 F и еще одна четверть в сильно асимметричной координации, где трудно сделать однозначный выбор между КЧ 4,5,6. Достаточно короткие (до 3,21 Å) расстояния Li-Li соединяют все позиции лития в двумерную сеть в плоскости y0z (рис. 2). Это позволяет ожидать достаточно высокую подвижность ионов лития в каркасе и возможность их извлечения с окислением никеля и сохранением исходного каркаса:
Li2Ni2+PO4F ® LiNi3+PO4F + Li+ + e ® Ni4+PO4F + 2 Li+ + 2 e
Но сведений о таких свойствах Li2NiPO4F в литературе не обнаружено. Можно было бы ожидать существование аналогичных фаз, содержащих на месте никеля другие катионы близкого размера с переменной степенью окисления (табл. 2), но никаких сведений о них в литературе также не обнаружено.
Таблица 2
Эффективные кристаллохимические радиусы [18] некоторых двухзарядных катионов в октаэдрической координации в высокоспиновом состоянии
|
M |
Mn2+ |
Fe2+ |
Co2+ |
Ni2+ |
|
VIR, Å |
0,97 |
0,92 |
0,885 |
0,83 |
В данной работе поставлена задача получения новых фаз состава Li2MPO4F, где M = Mn, Fe, Co, и исследования возможности окислительного извлечения лития из них и из ранее известного никелевого соединения. Предполагалось, что за счет удвоенного содержания лития можно будет повысить емкость электродного материала по сравнению с фазами типа оливина (табл. 3).
Таблица 3
Теоретические удельные емкости некоторых известных и предполагаемых материалов положительного электрода литий-ионного аккумулятора
|
Восстановленная форма |
Окисленная форма |
Емкость, А*час/кг |
|
LiMO2 (M = Co, Ni) |
Li0.5MO2 |
140 |
|
LiMPO4 (M = Mn, Fe, Co, Ni) |
MPO4 |
170 |
| Li2MPO4F (M = Mn, Fe, Co, Ni) |
LiMPO4F |
144 |
|
MPO4F |
288 |
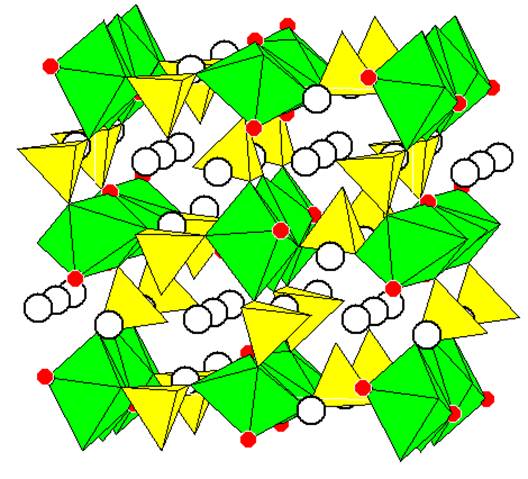 |
Рисунок 1
Полиэдрическое изображение кристаллической структуры Li2NiPO4F [10]
Зеленым цветом показаны октаэдры вокруг катионов никеля, желтым – тетраэдры PO4, красным – ионы фтора (в остальных вершинах – кислород), светлыми кружками показаны ионы лития.
