Понятие давления паров и теплоты
Итак, зная критические параметры Tc, Pc и c, можно рассчитать давление насыщенного пара при любой из интересующих температур. Для определения величины c можно использовать либо значение нормальной температуры кипения, либо известное давление насыщенного пара при какой-либо другой температуре. С аналогичным подходом мы уже встречались при определении величины ацентрического фактора.
Корреляция Фроста-Колкуорфа-Тодоса для давления паров
Фрост и Колкуорф интегрировали уравнение Клаузиуса-Клапейрона в приближении ![]() , но
, но ![]() они не считали величиной постоянной, а находили по уравнению Ван-дер-Ваальса. Результирующее уравнение лишь немного отличается от уравнения Риделя:
они не считали величиной постоянной, а находили по уравнению Ван-дер-Ваальса. Результирующее уравнение лишь немного отличается от уравнения Риделя:
![]() ,(7.17)
,(7.17)
однако величина D связана с константой Ван-дер-Ваальса “a” и критическими температурой и давлением:
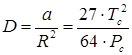 .(7.18)
.(7.18)
Тодос и его сотрудники детально исследовали уравнение (7.17) и предложили для константы “C” зависимость
![]() .(7.19)
.(7.19)
Используя уравнения для приведенных параметров, получена зависимость:
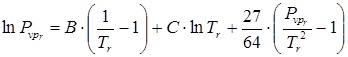 .(7.20)
.(7.20)
Константу “B” можно определить, если известно давление насыщенного пара вещества при какой-либо температуре. Так, для нормальной точки кипения имеем
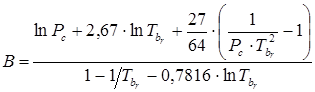 .(7.21)
.(7.21)
Из приведенного материала видно, что значения констант “B” и “C” в уравнении являются зависимыми от природы рассматриваемого вещества. Это должно приводить к лучшему предсказанию прогнозируемого свойства, чем при использовании корреляций “жесткого” типа, где константы имеют постоянное значение. К последним можно отнести, в частности, корреляцию Ли-Кеслера. Тем не менее корреляция Фроста-Колкуорфа-Тодоса используется в практических расчетах нечасто. Причиной тому служит определенное неудобство в ее применении, вызванное отсутствием P-T зависимости в явном виде. Конечно же, в настоящее время эти проблемы легко решаются, но существует некоторая инерция в отношении к применяемым подходам. Для облегчения вычислительных процедур Гарлахер и Браун на основе большого массива надежных экспериментальных данных рассчитали значения констант “B” и “C” для 242 веществ, которые приведены в [5]. Они также предложили приближенную корреляцию этих констант с парахором и фактором ацентричности.
В заключение следует сказать, что предпринималось множество других попыток улучшения подходов к интегрированию уравнения Клаузиуса-Клапейрона с целью обеспечения более тесной связи вида применяемых корреляций и природы соединений, для которых прогнозируются свойства. Обычно увеличение точности прогноза сопряжено с необходимостью привлечения дополнительной экспериментальной информации. Причем ее качество существенно влияет на качество прогноза. Так, например, метод Тека и Стила рекомендован для прогнозирования упругостей паров веществ, в том числе и сильно полярных или имеющих группы, участвующие в образовании ассоциатов. Для использования этого метода необходимо располагать сведениями по энтальпии испарения вещества при нормальной точке кипения, кроме критических параметров и Tb . Совершенно очевидно, что такой набор информации отсутствует для множества веществ. Кроме того, выполненная нами проверка метода на большом массиве соединений показала, что этим методом можно пользоваться только при наличии весьма точных данных. В противном случае предсказание дает большую ошибку, чем при использовании таких методов, как Ли-Кеслера, или эквивалентных ему. Применение методов, широко используемых при прогнозировании давлений насыщенного пара органических веществ, иллюстрируется примером 7.1.
