Правила, механизм и кинетика коагуляции
Если 0 < a < 1, наблюдается медленная коагуляция, т.е. только некоторые столкновения частиц приводят к их слипанию.
Чтобы частицы при столкновении слиплись, а не разлетелись как упругие шары, должен быть преодолен потенциальный барьер коагуляции ΔUк. Следовательно, коагуляция произойдет только в том случае, когда коллоидные частицы будут обладать кинетической энергией, достаточной дл преодоления этого барьера. Для увеличения степени коагуляции необходимо снижать потенциальный барьер. Это может быть достигнуто добавлением к золю электролита – коагулянта.
Зависимость скорости коагуляции от концентрации электролита представлена на рис. 3.1.2.5.
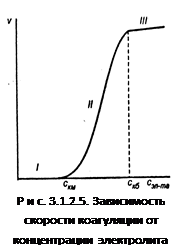
На графике видны три участка:
I. ![]() .
.
Следовательно, кинетическая энергия kТ << ΔUк, (k – постоянная Больцмана) – лиофобный золь агрегативно устойчив.
II. ![]() , т.е. потенциальный барьер коагуляции больше, но соизмерим с кинетической энергией коллоидных частиц, причем с увеличением концентрации электролита – коагулянта он уменьшается, а скорость коагуляции возрастает. Скм – порог медленной коагуляции, Скб – порог быстрой коагуляции. Этот участок кривой выражает зависимость:
, т.е. потенциальный барьер коагуляции больше, но соизмерим с кинетической энергией коллоидных частиц, причем с увеличением концентрации электролита – коагулянта он уменьшается, а скорость коагуляции возрастает. Скм – порог медленной коагуляции, Скб – порог быстрой коагуляции. Этот участок кривой выражает зависимость:
На этом участке происходит медленная коагуляция.
III. ![]()
Каждое столкновение приводит к слипанию частиц – идет быстрая коагуляция.
Теория быстрой коагуляции, разработанная М. Смолуховским в 1916 г., основана на следующих положениях.
1. Рассматриваемая система является монодисперсной, радиус частиц r.
2. ![]() , т.е. все столкновения являются эффективными.
, т.е. все столкновения являются эффективными.
3. Рассматриваются только столкновения первичных частиц.
4. Кинетика коагуляции подобна кинетике бимолекулярной реакции:
![]() ,
,
где k – константа скорости коагуляции.
Проинтегрируем это уравнение, разделив переменные:
![]()
![]() ,
,
где u0 – концентрация частиц золя в начальный момент времени;
ut – концентрация частиц золя в момент времени t.
Для характеристики быстрой коагуляции используется период коагуляции(период половинной коагуляции) q.
Период коагуляции (q) – это время, через которое концентрация коллоидных частиц уменьшается в два раза.
При ![]()
![]()
Согласно теории быстрой коагуляции, константа коагуляции зависит от коэффициента диффузии и может быть вычислена по уравнению
![]()
Если подставить в это уравнение величину коэффициента диффузии, получим:
![]()
Таким образом, зная вязкость дисперсионной среды и температуру, можно вычислить константу скорости быстрой коагуляции. Теория Смолуховского неоднократно проверялась экспериментально и получила блестящее подтверждение, несмотря на сделанные автором допущения.
Медленная коагуляция связана с неполной эффективностью столкновений вследствие существования энергетического барьера. Простое введение величины степени коагуляции a в формулы теории Смолуховского не привело к согласию теории с опытом. Более совершенную теорию медленной коагуляции разработал Н.Фукс. Он ввел в кинетическое уравнение коагуляции множитель, учитывающий энергетический барьер коагуляции ΔU к:
![]() ,
,
где kКМ – константа скорости медленной коагуляции;
kКБ - константа скорости быстрой коагуляции;
Р – стерический фактор;
ΔUк - потенциальный барьер коагуляции;
k – постоянная Больцмана.
Таким образом, для расчета константы скорости медленной коагуляции необходимо знать потенциальный барьер коагуляции, величина которого зависит прежде всего от z– потенциала.
Фактор устойчивости, или коэффициент замедления W, показывает, во сколько раз константа скорости медленной коагуляции меньше константы скорости быстрой коагуляции.
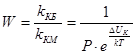 ,
,
Следует отметить пять факторов устойчивости, среди которых два первых играют главную роль.
1. Электростатический фактор устойчивости.
Он обусловлен наличием ДЭС и x– потенциала на поверхности частиц дисперсной фазы.
2. Адсорбционно – сольватный фактор устойчивости.
Он обусловлен снижением поверхностного натяжения в результате взаимодействия дисперсионной среды с частицей дисперсной фазы. Этот фактор играет заметную роль, когда в качестве стабилизаторов используются коллоидные ПАВ.
3. Структурно – механический фактор устойчивости.
Он обусловлен тем, что на поверхности частиц дисперсной фазы образуются пленки, обладающие упругостью и механической прочностью, разрушение которых требует времени и затраты энергии. Этот фактор устойчивости реализуется в тех случаях, когда в качестве стабилизаторов используются высокомолекулярные соединения (ВМС).
4. Энтропийный фактор устойчивости.
Коагуляция приводит к уменьшению числа частиц в системе, следовательно, к уменьшению энтропии (ΔS<0), а это приводит к увеличению свободной энергии системы ΔG>0. Поэтому система самопроизвольно стремится оттолкнуть частицы друг от друга и равномерно (хаотично) распределить по объему системы. Этим обусловлен энтропийный фактор устойчивости. Однако число частиц в коллоидном растворе по сравнению с истинным раствором такой же массовой концентрации гораздо меньше, поэтому роль энтропийного фактора невелика. Но если частицы стабилизированы веществами, обладающими длинными гибкими цепями (ВМС) и потому имеющими много конформаций, то при сближении таких частиц их защитные слои вступают во взаимодействие. Это взаимодействие непременно приводит к уменьшению числа возможных конформаций, а значит – к уменьшению энтропии. Поэтому система стремится оттолкнуть частицы друг от друга.
5. Гидродинамический фактор устойчивости.
Ему способствует увеличение плотности и динамической вязкости дисперсионной среды.
В реальных системах действуют, как правило, несколько факторов устойчивости. Каждому фактору соответствует специфический способ его нейтрализации. Это затрудняет создание общей теории устойчивости. Пока существуют лишь частные теории.
