Предельные и непредельные углеводороды
В обычных условиях молекулярный бром практически не реагирует с насыщенными углеводородами. Только в атомарном состоянии он способен вырывать атом водорода из молекулы алкана. Поэтому предварительно необходим разрыв молекулы брома до свободных атомов, которые зарождают цепную реакцию. Такой разрыв осуществляется под действием света, то есть при поглощении световой энергии молекула брома распадается на атомы брома с одним неспаренным электроном.
|
:Br:Br: |
––hn® |
:Br. + .Br: (зарождение цепи) |
Такой тип распада ковалентной связи называется гомолитическим расщеплением (с греческого homos – равный). Образующиеся атомы брома с неспаренным электроном очень активны. При их атаке молекулы алкана происходит отрыв атома водорода от алкана и образование соответствующего радикала.
|
CH3 \ |
H |
CH3 \ |
• |
|
CH– |
C–CH2–CH3 + •Br ® |
CH– |
C–CH2–CH3 + HBr (рост цепи) |
|
/ CH3 |
I CH3 |
/ CH3 |
I CH3 |
Частицы, имеющие неспаренные электроны и обладающие в связи с этим неиспользованными валентностями, называются радикалами. При образовании радикала атом углерода с неспаренным электроном меняет гибридное состояние своей электронной оболочки: от sp3 в исходном алкане до sp2 в радикале. Из определения sp2- гибридизации следует, что оси трех sp2- гибридных орбиталей лежат в одной плоскости, перпендикулярно к которой расположена ось четвертой атомной р- орбитали, не затронутой гибридизацией. Именно на этой негибридизованной р- орбитали находится в радикале неспаренный электрон. Образующийся в результате первой стадии роста цепи радикал атакуется далее исходной молекулой галогена.
|
CH3 \ |
• |
CH3 \ |
Br I | |||||
|
CH– |
C–CH2 –CH3 + |
:Br |
|
:Br: |
® |
CH– |
C–CH2–CH3 + |
:Br: (рост цепи) |
|
/ CH3 |
I CH3 |
/ CH3 |
I CH3 |
С учетом плоского строения алкила молекула брома атакует его равновероятно с обеих сторон плоскости – сверху и снизу. При этом радикал, вызывая в молекуле брома гомолитическое расщепление, образует конечный продукт и новый атом брома с неспаренным электроном, приводящий к дальнейшим превращениям исходных реагентов. Учитывая, что третий углеродный атом в цепи является асимметрическим, то в зависимости от направления атаки молекулы брома на радикал (сверху или снизу) возможно образование двух соединений, являющихся зеркальными изомерами. Наложение друг на друга моделей этих образующихся молекул не приводит к их совмещению. Если же поменять два любых шарика - связи, то совмещение очевидно. Обрыв цепи в данной реакции может происходить в результате следующих взаимодействий:
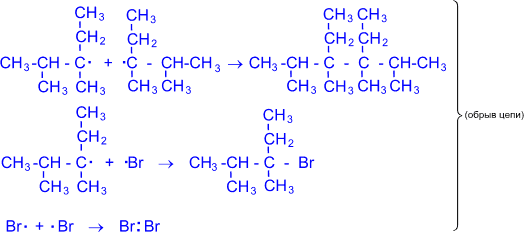
Подобно рассмотренной реакции бромирования осуществляется и хлорирование алканов.” Для изучения реакции хлорирования алканов смотри анимационный фильм "Механизм реакции хлорирования алканов"(данный материал доступен только на CD-ROM).
2) Нитрование. Несмотря на то, что в обычных условиях алканы не взаимодействуют с концентрированной азотной кислотой, при нагревании их до 140°С с разбавленной (10%-ной) азотной кислотой под давлением осуществляется реакция нитрования – замещение атома водорода нитрогруппой (реакция М.И.Коновалова). В подобную реакцию жидкофазного нитрования вступают все алканы, однако скорость реакции и выходы нитросоединений низкие. Наилучшие результаты наблюдаются с алканами, содержащими третичные углеродные атомы.
|
NO2 I | ||
|
CH3– |
CH–CH3(2- метилпропан) +…HNO3 ––t°,p® CH3– I CH3 |
C–CH3(2-нитро-2-метилпропан) + H2O I CH3 |
Реакция нитрования парафинов – радикальный процесс. Обычные правила замещения, рассмотренные выше, действуют и здесь. Отметим, что в промышленности получило распространение парофазное нитрование - нитрование парами азотной кислоты при 250-500°С.
3) Крекинг. При высокой температуре в присутствии катализаторов предельные углеводороды подвергаются расщеплению, которое называется крекингом. При крекинге происходит гомолитический разрыв углерод-углеродных связей с образованием насыщенных и ненасыщенных углеводородов с более короткими цепями.
CH3–CH2–CH2–CH3(бутан) ––400°C® CH3–CH3(этан) + CH2=CH2(этилен)
Повышение температуры процесса ведет к более глубоким распадам углеводородов и, в частности, к дегидрированию, т.е. к отщеплению водорода. Так, метан при 1500ºС приводит к ацетилену.
2CH4 ––1500°C® H–CºC–H(ацетилен) + 3H2
4) Изомеризация. Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с образованием алканов разветвленного строения.
