Применение ЭВМ в технологии лекарственных препаратов
Содержание.
1. Основы квантовой механики атома. Соотношение де Бройля. Уравнение Шредингера.
2. Ионная (гетерополярная) связь. Расчет энергии ионной связи.
3. Теория ковалентной (гомеополярной) связи. Метод валентных связей.
4. Теория ковалентной связи. Метод молекулярных орбиталей (МО).
5. Упрощенный метод МО Хюккеля.
6. Особенности квантово-химических методов.
7. Некоторые полуэмпирические методы.
8. Приближения молекулярной механики, лежащие в основе квантово-химических методов.
Литература.
1. Основы квантовой механики атома. Соотношение де Бройля. Уравнение Шредингера.
Химические процессы сводятся к превращению молекул, т.е. к возникновению и разрушению связей между атомами. Поэтому важнейшей проблемой химии всегда была и остается проблема химического взаимодействия, тесно связанная со строением и свойствами вещества. Современная научная трактовка вопросов химического строения и природы химической связи дается квантовой механикой – теорией движения и взаимодействия микрочастиц (электронов, ядер и т.д.).
Одним из общих свойств материи является ее двойственность. Частицы материи обладают одновременно и корпускулярными и волновыми свойствами. Соотношение "волна – частица" таково, что с уменьшением массы частицы ее волновые свойства все более усиливаются, а корпускулярные – ослабевают. Когда же частица становится соизмеримой с атомом, наблюдаются типичные волновые явления. Одновременно оказывается невозможным описание движения и взаимодействия микрочастиц-волн законами движения тел с большой массой. Первый шаг в направлении создания волновой, или квантовой механики, законы которой объединяют и волновые, и корпускулярные свойства частиц, сделал де Бройлем (1924). Де Бройль высказал гипотезу, что с каждой материальной частицей связан некоторый периодический процесс. Если частица движется, то этот процесс представляется в виде распространяющейся волны, которую называют волной де Дройля, или фазовой волной. Скорость частицы V связана с длиной волны λ соотношением де Бройля:
![]() (1)
(1)
где m – масса частицы (например, электрона);
h – постоянная Планка.
Уравнение (1) относится к свободному движению частиц. Если же частица движется в силовом поле, то связанные с ней волны описываются так называемой волновой функцией. Общий вид этой функции определил Шредингер (1926). Найдем волновую функцию следующим путем. Уравнение, характеризующее напряженность поля Еа плоской монохроматической волны света, можно записать в виде:
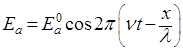 , (2)
, (2)
где Еа0 – амплитуда волны;
ν – частота колебаний;
t – время;
λ – длина волны;
х – координата в направлении распространения волны.
Так как вторые производные от уравнения плоской волны (2), взятые по времени t и координате х, равны соответственно:
![]() , (3)
, (3)
![]() , (4)
, (4)
то ![]()
Подставляя λ=с/ V (с – скорость света), получаем волновое уравнение для плоской световой волны:
![]() , (5)
, (5)
Последующие преобразования основываются на предположениях, что распространение волн де Бройля описывается аналогичным уравнением, и что эти волны становятся стационарными и сферическими. Сначала представим, что по уравнению (5) изменяется значение новой функции ψ от координат (χ, y, z), имеющей смысл амплитуды некоторого колебательного процесса. Тогда, заменяя Еа на ψ, получим волновое уравнение в форме:
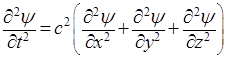 , (6)
, (6)
После исключения t (с помощью (3)) волновое уравнение примет вид:
![]() , (7)
, (7)
где ψ – так называемая волновая функция – величина, периодически изменяющаяся по закону гармонического движения;
ν2 – оператор Лапласа, означающий, что над функцией производится следующее действие:
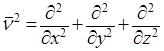 .
.
Будем считать, что волновое уравнение (7) описывает движение частицы. Тогда λ – длина фазовой волны, а ψ – амплитуда фазовой волны в любой произвольно взятой точке χ, y, z, характеризующей местоположение частицы. Длину и амплитуду фазовой волны можно связать с массой и энергией частицы. Если частица движется в потенциальном поле, то ее полная энергия Е складывается из кинетической энергии Ек = mV2/2 и потенциальной энергии Еп. Отсюда
½mV2 – Е – Еп или m2V2 = 2m(E – Eп).
Учитывая соотношение де Бройля, запишем
m2V2 = h2/λ2 и λ2 = h2/2m (E – Eп)
и представим волновое уравнение в следующем виде:
![]() (8)
(8)
В этой форме волновое уравнение называется уравнением Шредингера. Оно является основным уравнением квантовой механики.
Уравнение Шредингера – дифференциальное уравнение в частных производных и может иметь множество решений. Однако физический смысл имеют лишь те ψ-функции (так называемые собственные функции), которые удовлетворяют ряду условий. Во-первых, эти функции должны быть непрерывными, конечными, однозначными и обращаться в нуль на бесконечном расстоянии. Наложение перечисленных условий называется нормированием ψ-функции. Во-вторых, собственным ψ-функциям соответствуют не любые, а только дискретные значения полной энергии Е. Как дискретные значения энергии, так и вид собственных ψ-функций определяется совокупностью квантовых чисел n, l, m, которые хотя и не содержатся в самом уравнении Шредингера, но вводятся в него при решении. Таким образом, квантование энергии естественно и неизбежно вытекает из основных свойств материальных объектов и не нуждается в особом постулировании, которое было сделано Н. Бором при разработке планетарной модели атома.
2. Ионная (гетерополярная) связь. Расчет энергии ионной связи.
В зависимости от свойств элементов образующие химическую связь электроны могут находиться в различных энергетических и пространственных состояниях, в результате чего в молекулах возникают разные типы связей. С целью классификации выделяют обычно два основных типа связи – ионную и ковалентную. Однако это разделение условно и не отражает многообразия форм химического движения.
Связь называется ионной в том случае, когда между двумя атомами или группами атомов сильно преобладает электростатическое взаимодействие.
Сродством атома к электрону называется количество энергии Е, которое выделяется при присоединении электрона к нейтральному атому или отрицательному иону
