Прогнозирование энтропии образования органических веществ
Для соединений, имеющих гетероатомы, необходимо также рассматривать пространственное строение структурных фрагментов, в которые входят эти атомы. Например, аминогруппа вместе с ближайшим углеродным атомом обладает структурой пирамиды, поэтому для группы CNH2 число симметрии внутреннего вращения равно единице.
Итак, с вопросом определения чисел симметрии молекул мы в общих чертах познакомились. Наличие в молекуле осей симметрии внутреннего вращения понижает энтропию вещества. Чтобы ввести поправку на симметрию, необходимо из вращательной энтропии вычесть ![]() , т.е.
, т.е.
![]() . (2.8)
. (2.8)
Иной тип поправок приходится вводить в случае, когда интересующее нас вещество имеет хиральные центры и вследствие этого представлено смесью устойчивых форм вращательных изомеров (возможны и другие ситуации). Поскольку энтропия отражает степень упорядоченности системы, то для смеси изомеров необходимо учитывать энтропию смешения
![]() , (2.9)
, (2.9)
где ni - мольная доля i-того изомера в равновесной смеси. Если все изомеры имеют равную энергию, то ni = 1/n и
![]() . (2.10)
. (2.10)
Следовательно, для бинарной смеси с концентрацией каждого изомера 50% или 0,5 мол. долей имеем ![]() = 5,76 Дж/(моль×К).
= 5,76 Дж/(моль×К).
Количество пространственных изомеров органического соединения может быть весьма значительным и зависит от количества элементов хиральности в молекуле, которыми могут быть [31]:
· асимметрические углеродные атомы, т.е. атомы, у которых все четыре заместителя разные, например, центральный атом углерода в молочной кислоте
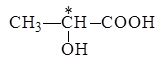 ;
;
· атомы кремния с четырьмя различными заместителями, например, в молекуле метил-(1-нафтил)фенилсилана;
· атомы трехвалентного фосфора в фосфинах или четырехвалентной серы в сульфоксидах с набором различных заместителей при фосфоре или сере, в соединениях которых заместители расположены пирамидально, но структуры являются фактически тетраэдрическими с учетом свободной электронной пары;
· центр молекулы адамантанового ядра с различными заместителями в 1,3,5,7-положениях адамантана;
· оси хиральности, например, для молекул алленов с различными заместителями при крайних углеродных атомах или для 2,2',6,6'-тетра-замещенных бифенилов, размеры заместителей в молекулах которых препятствуют вращению вокруг простой углерод-углеродной связи между ароматическими ядрами, если сумма ван-дер-ваальсовых радиусов орто-заместителей превосходит 0,290 нм; таким соединениям свойственна пространственная изомерия (атропоизомерия - где тропос - поворот (греч.), атропо- нет поворота);
· плоскости хиральности, например, в производных ферроцена;
· спиральность, например, в белках, нуклеиновых кислотах или гелиценах (простейшая модель спиральности) с шестью и более орто-конденсированными бензольными ядрами, которые не могут расположиться в одной плоскости и образуют правую или левую спираль.
Из перечисленных элементов хиральности для относительно несложных структур наиболее часто встречающимися являются асимметрические углеродные атомы. В этом случае максимальное количество оптических изомеров равно ![]() , где “m” - число асимметрических атомов углерода.
, где “m” - число асимметрических атомов углерода.
Если набор заместителей при различных асимметрических углеродных атомах одинаков, то количество оптических изомеров уменьшается вследствие образования мезо-формы. При расчете величины поправки на смешение оптических изомеров в этом случае концентрация мезо-формы в первом приближении может быть принята равной суммарной концентрации равновесной с ней dl-формы. Таким образом, для структур с двумя асимметрическими атомами в молекуле имеем поправку на смешение оптических изомеров, равную
![]() = –8,3147·(0,5·ln(0,5)+0,25·ln(0,25)+0,25·ln(0,25)) =
= –8,3147·(0,5·ln(0,5)+0,25·ln(0,25)+0,25·ln(0,25)) =
= 8,64 Дж/(моль×К).
Если центры асимметрии находятся не при соседних атомах, то весь соединяющий их фрагмент считают за одну связь.
Наличие асимметрических углеродных атомов в циклических соединениях также требует при прогнозировании энтропии учета вклада на смешение оптических изомеров. Однако при этом необходимо учитывать специфику строения молекул интересующего циклического соединения.
Так, например, в молекулах монозамещенных циклогексанов (ЦГ) заместитель может находиться в двух различных положениях - экваториальном и аксиальном. Однако при этом не возникает никаких изомеров, поскольку в результате инверсии цикла аксиальный заместитель становится экваториальным, и наоборот.
В случае дизамещенных циклогексанов с заместителями у разных атомов цикла молекула имеет два асимметрических атома углерода и, по аналогии с нециклическими структурами, должна бы существовать в виде смеси четырех оптических изомеров, если заместители различны. Тем не менее, в сопоставимых концентрациях реализуются в большинстве случаев два изомера - например, экваториально-аксиальный (еа) для цис-1,2-дизамещенного-ЦГ и экваториально-экваториальный (ее) для транс-1,2-ЦГ.
Неоднозначность учета вклада на смешение пространственных изомеров становится еще большей при переходе от моноциклических структур к полициклическим. В качестве примера можно привести монозамещенные (в любом из метиленовых фрагментов) производные норборнана - бицикло[2.2.1]гептана и гидриндана - бицикло[4.3.0]нонана. Каждое из них имеет три асимметрических углеродных атома: два узловых и один - с заместителем. Однако для производных норборнана количество стереоизомеров равно четырем, а для гидриндана, как и положено, восьми. Объясняется такое различие тем, что конфигурацию узловых атомов в молекуле норборнана можно изменить только одновременно по причине жесткости структуры. Ясно, что при таком различии в количестве стереоизомеров вклады в энтропию, обусловленные их смешением, будут различны. Ясно также и то, что введение поправки на смешение изомеров для циклических структур требует дополнительных экспериментальных или расчетных сведений о соотношении равновесных концентраций всех возможных стереоизомеров.
Прочие вопросы прогнозирования ![]() органических соединений методом Бенсона решаются в той же последовательности, что и прогнозирование
органических соединений методом Бенсона решаются в той же последовательности, что и прогнозирование ![]() (разд. 1.), т.е. вычисляется аддитивная составляющая энтропии (табл. 1.2.) и вводятся необходимые поправки. Последние включают в себя поправки, обусловленные специфическими особенностями строения молекул данного класса соединений и включенные в таблицу парциальных вкладов метода Бенсона (табл. 1.2), а также упомянутые выше статистические поправки - на симметрию молекулы рассматриваемого вещества и число оптических изомеров, его представляющих. Сказанное иллюстрируется примерами 2.1-2.3.
(разд. 1.), т.е. вычисляется аддитивная составляющая энтропии (табл. 1.2.) и вводятся необходимые поправки. Последние включают в себя поправки, обусловленные специфическими особенностями строения молекул данного класса соединений и включенные в таблицу парциальных вкладов метода Бенсона (табл. 1.2), а также упомянутые выше статистические поправки - на симметрию молекулы рассматриваемого вещества и число оптических изомеров, его представляющих. Сказанное иллюстрируется примерами 2.1-2.3.
