Производство азотных удобрений
Грануляционная башня имеет прямоугольное сечение 11х8 м2 и высоту около 61 м. Через отверстие в нижней части в башню поступает наружный воздух и воздух из охладителя гранул. Поступающий в верхнюю часть башни плав нитрата аммония диспергируется с помощью трех виброакустических грануляторов, в которых струя плава превращается в капли. При падении капель с высоты около 10 м они затвердевают и превращаются в гранулы. Кристаллизация плава с влажностью 0,2% начинается при 167ºС и заканчивается при 140 ºС. Объем воздуха, подаваемого в башне, составляет в зависимости от времени года 300 – 100 м3/час.
В установках АС – 72М применяется магнезиальная добавка против слеживаемости продукта (нитрат магния). Поэтому операции обработки гранул ПАВ, предусмотренной в схемах АС – 67 и АС – 72, не требуется.
Принципиальными отличиями технологической схемы производства нитрата аммония безупарочным методом (рис. 1.4.) являются: использование более концентрированной азотной кислоты; проведение процесса нейтрализации при повышенном (0,4МПа) давлении; быстрый контакт нагретых компонентов.
В этих условиях на стадии нейтрализации образуется парожидкостная эмульсия, после разделения которой получают плав концентрацией 98,1%, что позволяет исключить отдельную стадию упаривания раствора.
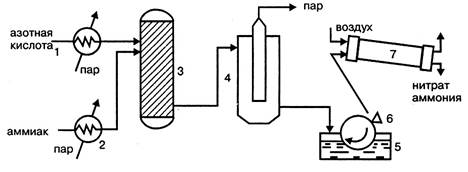
Рисунок 1.4 - Технологическая схема безупарочного метода:
1 – подогреватель азотной кислоты; 2 – подогреватель аммиака; 3 – реактор (нейтрализатор); 4 – сепаратор эмульсии; 1 – барабанный кристаллизатор; 6 – нож; 7 – барабанная сушка.
Нагретые в нагревателях 1 и 2, обогреваемые паром, выходящим из сепаратора, эмульсии 4, азотная кислота и аммиак поступают в нейтрализатор 3, где в результате реакции образуется эмульсия из водного раствора нитрата аммония и водяного пара. Эмульсия разделяется в сепараторе 4 и плав нитрата аммония подается в барабанный кристаллизатор 1, в котором нитрат аммония кристаллизируется на поверхности металлического барабана, охлаждаемого изнутри водой.
Образовавшийся на поверхности барабана слой твердого нитрата аммония толщиной около 1 мм срезается ножом 6 и в виде чешуек поступает для просушивания в барабанную сушилку 7. Подобный продукт в виде чешуек используется для технических целей.
1.3 Производство карбамида
1.3.1 Свойства карбамида
Карбамид (мочевина) – диамид угольной, или амид карбаминовой кислот CO(NH2)2. Генетическая связь производных угольной кислоты может быть выражена следующей схемой:
ОН ОН ОNН4 NН2
| | | |
C=О C=О C=О C=О
| | | |
ОН NН2 NН2 NН2
угольная карбаминовая карбамат карбамид
кислота кислота аммония
Карбамид представляет собой твердое кристаллическое вещество с температурой плавления 132,7ºС. Хорошо растворим в воде, этаноле и жидком аммиаке, что используется для получения аммиакатов. При нагревании выше 130 ºС подвергается термической диссоциации с образованием биурета и выделением аммиака:
2CO(NH2)2 = H2N – CO – NH – СО – H2N + NH3.
Водные растворы карбамида устойчивы до 80 ºС, при более высокой температуре разлагаются через образование карбоната аммония на аммиак и оксид углерода (IV):
CO(NH2)2 + 2H2O Û (NH4)2CO3 Û (NH4)2HCO3 + Û
Û CO2 + H2O + 2NH3.
Это исключает возможность длительного нагревания растворов карбамида при атмосферном давлении, например, в процессе выпаривания.
Карбамид – безбалластное высококонцентрированное МУ. Он легко усваивается растениями. Содержание азота в нем в амидной форме составляет 46,6%. По сравнению с нитратом аммония карбамид более богат азотом, меньше слеживается, не взрывоопасен в смесях с органическими веществами и медленнее вымывается из почвы.
1.3.2 Физико-химические основы процесса синтеза
В основе получения карбамида лежит взаимодействие аммиака с оксидом углерода (IV) с последующей дистилляцией продуктов синтеза и переработкой полученных растворов. При синтезе карбамида последовательно протекают две обратимых реакции:
образование карбамата аммония:
2NH3 + CO2 Û CO(NH2)(ONH4) – 121,6 кДж (1)
и дегидратации карбамата аммония до карбамида:
CO(NH2)(ONH4)ÛCO(NH2)2 + H2O–11,1 кДж (2)
Процесс синтеза описывается суммарным уравнением:
2NH3 + CO2 = CO(NH2)2 + H2O – 110,1кДж.
Он протекает в гетерогенной системе, состоящей из газообразной фазы (аммиак, диоксид углерода, пары воды) и жидкой фазы, включающей расплавленные и растворенные компоненты (аммиак, карбамат аммония, карбонаты аммония, карбамид) и воду.
Скорости реакций 1 и 2 различны. Реакция 1 протекает значительно быстрее реакции 2, поэтому лимитирующей процесс синтеза стадией, от которой и зависит выход продукта, является стадия дегидратации карбамата аммония 2. Состояние равновесия и скорость ее определяются температурой, давлением, соотношением аммиака и диоксида углерода и содержанием воды в реакционной смеси.
Скорость реакции 2 возрастает с увеличением температуры и давления. Так как она протекает с поглощением тепла, то повышение температуры одновременно способствует смещению равновесия вправо и увеличивает степень конверсии карбамата аммония.
Повышение температуры быстро смещает равновесие реакции 1 влево, что приводит к уменьшению концентрации карбамата и, следовательно, к падению скорости реакции 2 конверсии карбамата в карбамид.
Максимальная степень превращения карбамата аммония в карбамид достигается при температуре около 220ºС. При этой температуре продолжительность процесса составляет около 60 минут. При понижении температуры для достижения более высокой степени превращения карбамата в карбамид время процесса существенно увеличивается.
Скорость образования карбамата аммония возрастает пропорционально квадрату давления и при давлении 1 МПа протекает практически мгновенно.
Наибольшее влияние на выход карбамида оказывает избыток аммиака в исходной смеси сверх стехиометрического количества (NH3 : CO2 – 2 : 1). Избыток аммиака смещает равновесие реакции 1, а также вследствие своего дегидратирующего действия связывает реакционную воду, удаляя ее из сферы реакции, и смещает вправо равновесие реакции 2. Образование карбамата и его дегидратация до карбамида протекают в жидкой фазе, поэтому в реакторе должны быть созданы условия ее существования. Этому способствует увеличение степени заполнения реактора, что приводит к уменьшению объема газовой фазы, и нагрев реакционной смеси до температуры выше эвтектической точки системы «карбамат-карбамид», равной 98ºС.
Влияние различных факторов на состояние равновесия системы «карбамат-карбамид» можно представить в виде следующей схемы:
 Т (за счет экзотермичности реакции 1)
Т (за счет экзотермичности реакции 1)
сдвиг влево
сдвиг вправо
Р
(за счет ускоре- (за счет подав- NH3/CO2
ния наступления ления диссоци- (за счет связывания
