Производство нитроаммофоса
2.5. Характеристика побочных продуктов и способы их утилизации.
Отходящие газы производства аммофоса содержат аммиак, а также аммофосную пыль. Пыль выделяется от грануляционно-сушильных аппаратов, дробильно-сортировочного оборудования, транспортных средств и при затаривании аммофоса. Аммиак переходит в газовую фазу в основном при сушке пульпы и влажных гранул и при упаривании аммофосной пульпы. Перед выбросом газов в атмосферу их очищают сначала от пыли – в циклонах, а затем от аммиака и фтора – в абсорберах.
2.5.1. Удаление пыли
Эффективное осаждение твердых частиц из запыленного газа осуществляется в центробежных аппаратах. В целях высокой степени очистки газа недопустимо накопление пыли в конусе циклона. Даже небольшие подсосы воздуха через неплотности аппаратуры на любом участке пылеуловительной системы резко ухудшают работу циклона и могут свести на нет эффективность работы аппарата. Степень очистки газа от пыли в циклонах зависит от свойств частиц газа, скорости движения потока, от размеров и конструктивных особенностей циклонных аппаратов.
2.6.1 Удаление аммиака
Выделение аммиака в процессе сушки происходит в результате термического разложения солей, входящих в состав аммофоса, по следующим реакциям:
(NH4)2HPO4 ↔ NH3 + NH4H2PO4 (2.6.1.1)
NH4H2PO4 ↔ NH3 + H3PO4 (2.6.1.2)
В процессе производства аммофоса значительно разлагается только диаммонийфосфат, отличающийся низкой термической устойчивостью. При этом в газовую фазу выделяется в основном аммиак.
Для улавливания аммиака и фтора из отходящих газов применяется двухступенчатая очистка газов. Абсорбер первой ступени, орошаемый в замкнутом цикле кислыми растворами фосфатов аммония, служит в основном для улавливания аммиака и частично (50%) фтора, абсорбер второй ступени, орошаемый водой или известковым молоком, - для улавливания фтора. Принципиальная схема абсорбции отходящих газов приведена на рисунке 6.1.
Газы поступают в абсорбер первой ступени 1, орошаемый кислыми фосфатами аммония в замкнутом цикле. Отработанная пульпа поступает на нейтрализацию.
Абсорбер второй ступени 2, орошаемый водой или известковым молоком, служит для улавливания фтора. На второй ступени абсорбции можно использовать полую башню с форсунками эвольвентного типа. Отработанная жидкость после второй ступени (при орошении водой) направляется в циркуляционный бак 3 первой ступени. В случае орошения абсорбера над раствором известкового молока жидкость откачивается на станцию нейтрализации сточных вод.
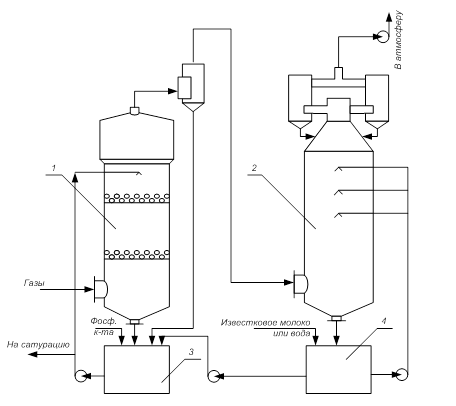
1 – абсорбер с плавающей насадкой; 2 – полая башня; 3 – емкость для фосфорной кислоты;
4 – емкость для воды или известкового молока.
Рисунок 6.1 – Схема двухступенчатой абсорбции отходящих газов производства аммофоса
2.6. Технологические расчеты
Блок схема производства аммофоса по схеме с аппаратом БГС
NH3 жид. H3PO4 ж (42% P2O5)

![]()
|
2.6.1.Расчет материального баланса
Расчет проведем на 1000 кг фосфорной кислоты, содержащей:
42% P2O5 или 57,96% H3PO4 , 2% H2SO4, 1,6% MgO, 0,2% CaO, 1% Al2O3, 1% Fe2O3 , 36,24% H2O
Состав аммиака:
99% NH3, 1% H2O
Таблица 3
Состав
|
Вещество |
% содержание |
Масса, кг |
|
Фосфорная кислота: H3PO4 H2SO4 MgO CaO Al2O3 Fe2O3 H2O |
42% на P2O5 57,963 2,00 1,60 0,20 1,00 1,00 36,24 |
1000,00 579,60 20,00 16,00 2,00 10,00 10,00 362,40 |
|
Аммиак: NH3 H2O |
99,00 1,00 |
132,80 131,50 1,30 |
В результате обработки фосфорной кислоты аммиаком образуется пульпа и испаряется некоторое количество воды. Состав образующейся массы определяется взаимодействием кислоты с содержащимися в примесями и аммиаком. В основу расчета количеств получаемых солей берем следующие стехиометрические соотношения:
NH3 + H2PO4 ® NH4H2PO4 (2.6.1)
2NH3 + H3PO4 ® (NH4)2HPO4 (2.6.2)
MgO + H3PO4 + 2H2O ® MgHPO4 * 3H2O (2.6.3)
CaO + H3PO4 + H2O ® CaHPO4 * 2H2O (2.6.4)
Al2O3 + 2H3PO4 ® 2AlPO4 + 3H2O (2.6.5)
Fe2O3 + 2H3PO4 ® 2FePO4 + 3H2O (2.6.6)
2NH3 + H2SO4 ® (NH4)2SO4 (2.6.7)
По реакции (2.6.3):
Известно, что mMgO= 16,00 кг, исходя из соотношения молярных масс можно вычислить:
mH3PO4= 39,20 кг, mH2O=14,40 кг, mMgHPO4*3H2O= 69,10 кг.
По реакции (2.6.4):
mCaO= 2,00 кг
mH3PO4= 3,50 кг, mH2O=0,64 кг, mCaHPO4*2H2O= 6,10 кг.
По реакции (2.6.5):
mAl2O3= 10,00 кг
mH3PO4= 19,20 кг, mH2O=5,30 кг, mAlPO4= 23,00 кг.
По реакции (2.6.6):
mFe2O3= 10,00 кг
mH3PO4= 12,25 кг, mH2O=3,40 кг, mFePO4= 25,00 кг.
По реакции (2.6.7):
mH2SO4= 20,00 кг
m(NH4)2SO4= 26,00 кг, mNH3=6,9 кг.
Таким образом на побочные реакции ушло 74,15 кг фосфорной кислоты и 6,90 кг аммиака. Следовательно оставшаяся фосфорная кислота (579,60-74,15=505,50 кг) пойдет на основные реакции (2.6.1) и (2.6.2).
Зная, что в готовом продукте соотношение количества моноаммонийфосфата к количеству диаммонийфосфата составляет 80%:20%, т.е. относится как 4:1, то рассчитаем соотношение количеств фосфорной кислоты, необходимых для реакций (2.6.1) и (2.6.2).
![]() ,
,
тогда
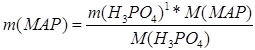 ,
,
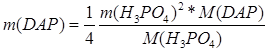 ,
,
где m(MAP), m(DAP) – масса моноаммонийфосфата и диаммонийфосфата соответственно; ![]() ,
, ![]() – массы фосфорной кислоты, необходимая для реакции образования МАФ (2.6.1) и реакции образования ДАФ (2.6.2) соответственно; M(MAP), M(DAP) – молярные массы МАФ и ДАФ соответственно;
– массы фосфорной кислоты, необходимая для реакции образования МАФ (2.6.1) и реакции образования ДАФ (2.6.2) соответственно; M(MAP), M(DAP) – молярные массы МАФ и ДАФ соответственно; ![]() – молярная масса фосфорной кислоты.
– молярная масса фосфорной кислоты.
найдем отношение масс фосфорной кислоты,
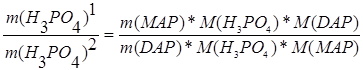 ,
,
