Пятая побочная подгруппа Периодической системы элементов Д.И. Менделеева
Глава IV. Тантал
В честь древнего героя Тантала назван металл, значение которого в наши дни неизменно растет. С каждым годом расширяется круг его применений, а вместе с этим и потребность в нем. Однако руды его редки и содержание в них тантала невысокое.
Одним из сырьевых источников тантала являются шлаки оловянных концентратов. Промышленность поистине испытывает «танталовы муки» по поводу нехватки тантала.
IV.1. Тантал в свободном состоянии
Синеватый металл серого цвета, с исключительно прочной связью между атомами, что обусловливает большие значения его температур плавления (3000°С) и кипения (5300°С), Легко обрабатывается на холоду давлением. Механические свойства тантала лучше, чем у ниобия. Как при высоких, так и при низких температуpax он бывает пластичен и не становится хрупким даже при температуре жидкого азота ( -196°С). Если содержит примеси азота, водорода, кислорода и углерода,тосвойства резко ухудшаются. Поэтому получение его в возможно чистом виде - основная задача при переработке танталового сырья. Даже если его значительно меньше, чем ниобия, и содержание составляет 0,01%, все равно это сырье представляет промышленную ценность. Кропотливой обработкой: обогащением, рудоразборкой, гравитационными методами с последующей флотацией, электромагнитной, электростатической или радиометрической сепарацией - создают танталовые концентраты. Они содержат до 60% (и даже больше) оксидов тантала и ниобия. Дальнейшая обработка происходит, как уже описано в разделе о ниобии. Конечными продуктами разделения обычно являются: оксид тантала Ta2O5, фторотанталат калия K2TaF7 или пентахлорид TaCl5.
Существо проблемы получения металлического тантала связано с двумя его свойствами, которые, казалось бы, противоречат друг другу: он тугоплавок, но при небольшом нагревании легко вступает в реакцию окисления. Это преодолевают, применяя электрохимическое восстановление, а также восстановлением натрием или углем. Полученный в виде порошка или брикетов металлический тантал подвергают дальше спеканию с одновременным рафинированием в вакууме (рис. 39). В последние годы, так же как и для выплавки ниобия, все шире применяется дуговая или электронно-лучевая плавка, при этом происходит особенно сильная очистка металлов. Несмотря на трудность обработки и получения, сейчас за рубежом в год выпускают примерно 300 — 400 т чистого металла.
 Тантал более редкий и дорогой металл, чем ниобий: применение этого элемента отчасти сдерживается высокой его ценой. Потребность в тантале особенно велика в новейших отраслях производства. Атомная техника: самые ответственные части ядерных реакторов делаются из металлического тантала. Он может выдерживать большие температуры, не вступая во взаимодействие с теплоносителями и металлическим топливом. Металлургия: в состав сверхтвердых сплавов на ряду с карбидами вольфрама и титана входит карбид тантала ТаС (tпл = 3800°С). Химическая промышленность: используется высокая коррозийная устойчивость тантала, не снижающаяся при нагревании.
Тантал более редкий и дорогой металл, чем ниобий: применение этого элемента отчасти сдерживается высокой его ценой. Потребность в тантале особенно велика в новейших отраслях производства. Атомная техника: самые ответственные части ядерных реакторов делаются из металлического тантала. Он может выдерживать большие температуры, не вступая во взаимодействие с теплоносителями и металлическим топливом. Металлургия: в состав сверхтвердых сплавов на ряду с карбидами вольфрама и титана входит карбид тантала ТаС (tпл = 3800°С). Химическая промышленность: используется высокая коррозийная устойчивость тантала, не снижающаяся при нагревании.
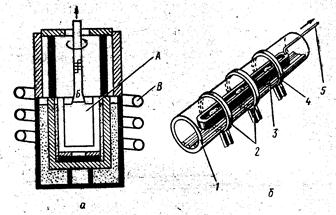
Рис. 3. Методы получения металлов,
Непрерывная плавка (а):
А - расплав,
Б - вращающаяся затравка,
В-медные трубки охлаждения.
Восстановление водородом (б):
1- кварцевая ила металлическая труба,
2 - держатели или кольцевые нагреватели,
3 - лодочка или емкость для образца,
4 - образцы,
5 - рычаг управления движением образцов.
Перечень хороших качеств металлического тантала (твердость, ковкость на холоду, пластичность, устойчивость к химическим воздействиям) следует дополнить особым свойством В отличие от других металлов тантал совершенно не раздражает соприкасающуюся с ним живую ткань. Тонкие пластиной и проволока из тантала — ценнейший материал костной и пластической хирургии. Танталовые заплаты на черепе, скрепление костей и даже сшивание нервов стали возможны благодаря такому удивительному свойству этого металла.
IV.2. Химические свойства тантала
Различие свойств тантала в виде кусков и порошкообразного так велико, что кажется, будто это два разных металла. Порошок при нагревании довольно энергично взаимодействует с кислородом (280°С):
4Та+5О2 = 2Та2О5,
с галогенами (250 — 300°С):
2Ta + 5Cl2 = 2TaCl5,
с серой
Ta + 2S = TaS2
и даже с азотом (при накаливании до 600о С в токе азота):
2Ta +N2 = 2TaN
Металлический тантал же устойчив в подавляющем большинстве агрессивных сред. На него не действуют никакие кислоты и даже «царская водка». Исключение составляет лишь плавиковая кислота H2F2, но это из-за присутствия в ней иона фтора. Очень слабо действуют на него даже расплавы щелочей.
Секрет устойчивости металлического тантала состоит в том, что на его поверхности всегда имеется тонкая, но прочнейшая пленка оксида Ta2O5. Если вещество или соединение может вступать во взаимодействие с этой пленкой или проникать сквозь нее, то оно будет разрушать металл, а если нет, то тантал будет сохранять свою «неприступность». К реагентам, обладающим разрушительной способностью, относятся: ионы фтора, оксид серы (VI) да еще расплавы щелочей. Эта же пленка препятствует протеканию электрического тока от металла в раствор при электролизе (когда танталовый электрод служит анодом). Поэтому тантал используется в электронной технике для изготовления выпрямителей тока.
В отсутствие кислорода и азота тантал устойчив ко многим жидким металлам. Обескислороженный металлический натрий не действует на него даже при 1200°С, магний и сплавы — уран-магний и плутоний-магний — при 1150°С. Это позволяет использовать тантал для изготовления некоторых деталей ядерных реакторов.
Тантал способен поглощать довольно значительные количества (до 1%) водорода, кислорода и азота. Происходит процесс, который называется абсорбцией, — явление поглощения какого-либо вещества всем объемом поглотителя без образования прочных соединений. Подобный процесс обратим. Поглощенный водород при нагревании металла в вакууме при 600°С весь выделяется. Металл, которому водород придал хрупкость, восстанавливает свои прежние механические качества. Свойством тантала растворять газы пользуются, когда вводят его в качестве добавки в сталь.
При. повышенной температуре происходит образование соединений. При 500°С могут существовать гидриды Та2Н или ТаН в зависимости от содержания водорода в металле. Выше 600 — 700°С при взаимодействии с кислородом возникает оксид Та2О5, примерно при такой же температуре идет реакция с азотом — появляется нитрид тантала TaN. Углерод при высокой температуре (1200—1400°С) соединяется с танталом, давая ТаС — тугоплавкий и твердый карбид.
В расплавленных щелочах тантал окисляется с образованием солей танталовой кислоты, которые скорее можно считать смешанными оксидами 4Na2O.3Та2О5.25Н2О; 4К2О.3Та2О5.16Н2О. В плавиковой кислоте тантал растворяется с образованием фторидных комплексов типа [ТаF6]-, [TaF7]2-, [TaF8]3-. Так как комплексы неустойчивы и гидролизуются, то в растворе находятся комплексы - продукты гидролиза [ТаОF5]2-, [TaOF6]3-.
