Равновесия в неводных растворах
В растворителях с высокими диэлектрическими проницаемостями электролитическая диссоциация может протекать полностью и равновесная концентрация ионизованного комплекса будет пренебрежимо мала. Однако это не означает, что электролитный раствор мог образоваться, минуя стадию ионизации. Развитие методов изучения быстрых реакций показывает, что даже в растворителях с весьма высокими диэлектрическими проницаемостями (вода, серная кислота) возникновению свободных ионов неизбежно предшествует стадия ионизации.
4. Электролитическая диссоциация.
Ионизация сольвата является необходимым, но еще не обязательным условием образования электролитного раствора. Обязательным же условием диссоциации ионизированного комплекса на ионы является достаточно высокая диэлектрическая проницаемость раствора. Лишь в этом случае ионизованный комплекс распадается на ионы:

Несмотря на то, что полная ионизация протекает достаточно часто, полная электролитическая диссоциация (сильные электролиты) наблюдается значительно реже. Абсолютно подавляющее большинство изученных электролитных неводных растворов образовано слабыми электролитами, реже — электролитами средней силы.
Основные методы определения константы электролитической диссоциации обычно сводятся к кондукто- либо потенциометрическим методикам и приложимы лишь к весьма разбавленным растворам. Другие методы определения констант диссоциации (например, спектрофотометрические) имеют ограниченное применение.
Современный арсенал методов исследования растворов позволяет почти всегда уверенно определять число стадий для каждого конкретного объекта.
ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА РАВНОВЕСИЕ В ХИМИЧЕСКИХ СИСТЕМАХ
Проблема влияния растворителя на равновесие процессов, протекающих в химических системах, сводится в первую очередь к рассмотрению двух вопросов — как изменяется равновесие процесса при переходе из газовой фазы в данный растворитель и от; одного растворителя к другому.
Влияние физических свойств растворителя на константы равновесия процессов в химических системах может быть объяснено с электростатических позиций, если учесть, что в значительном числе случаев в первом приближении химические процессы сводятся к электростатическому взаимодействию, константа равновесия которого описывается уравнением Борна:
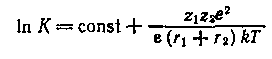
Из уравнения следует, что из физических свойств растворителя, определяющих константу равновесия, основным является диэлектрическая проницаемость. Действительно, почти во всех случаях можно установить весьма простую корреляцию между константами равновесий разнообразных процессов и диэлектрической проницаемостью.
Влияние диэлектрической проницаемости на равновесие в химических системах может быть установлено и в случае взаимодействия двух диполей.
1. Влияние растворителя на молекулярные ассоциативно-диссоциативные процессы
Во многих случаях молекулярная диссоциация ассоциированных компонентов, образующих жидкий раствор, обусловлена химическим взаимодействием между ними.
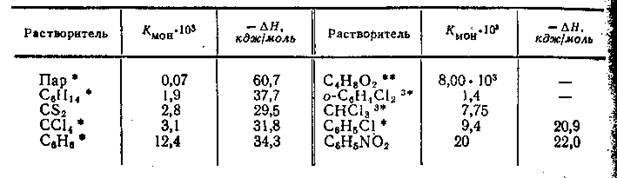
Табл.1. Константы равновесия и теплоты процесса (в кДж/моль) диссоциации димеров уксусной кислоты в различных растворителях
В табл.1 приведены значения констант равновесия про цесса распада димеров уксусной кислоты B паре и различных растворителях. Несмотря на то, что таблица составлена по данным различных авторов и данные эти относятся к довольно широкому интервалу температур, можно установить четкую корреляцию между ассоциированным состоянием уксусной кислоты и химическими свойствами растворителя. В паре молекулы уксусной кислоты практически полностью являются димерными. Во всех растворителях уксусная кислота находится в виде равновесной смеси димерных и мономерных молекул. Нетрудно заметить, что на положение равновесия диэлектрическая проницаемость оказывает гораздо меньшее влияние, чем химические свойства растворителей. Так, в растворителях, характеризующихся весьма близкими значениями ε — гексане,
сероуглероде, четыреххлористом углероде, бензоле и диоксане, величины Кмон различается весьма существенно. В химически инертных по отношению к уксусной кислоте растворителях равновесие практически смещено в сторону димера. Величина Кмон в бензоле приблизительно на порядок выше, чем в остальных инертных растворителях, что обусловлено взаимодействием (впрочем, довольно слабым) кислоты с бензолом по π-связям последнего. В диоксане же, который является растворителем с отчетливо выраженными основными свойствами, равновесие уже значительно смещено в сторону мономера.
Химические свойства растворенного вещества также в значительной степени определяют его ассоциативное состояние. Так, величины Кмон растворов уксусной, монохлоруксусной и трихлоруксусной кислот в диоксане, рассчитанные по криоскопическим данным составляют 0,8; 24 и ∞, т. е. увеличиваются по мере увеличения степени взаимодействия кислот с растворителем.
Причиной, обусловливающей распад ассоциированных молекул многих веществ, ншшстся в большинстве случаев образование Н-связи между компонентами раствора. Как известно, мерой прочности Н-связи (а, соответственно, и степени распада ассоциатов) является сдвиг максимума полосы поглощения, относящейся к группировке, которая участвует в образовании Н-связи. Спектроскопическая литература изобилует примерами, иллюстрирующими эту закономерность.
Влияние растворителя на ассоциативное состояние растворенного вещества связано прежде всего с ε. Это влияние отчетливо сказывается лишь в тех растворителях, энергией взаимодействия которых с растворенным веществом можно пренебречь по сравнению с энергией связи молекул в ассоциате. Можно установить влияние растворителя и на константу равновесия конформационных превращений молекул в растворах. Поскольку последние сопряжены с изменением дипольного момента, молекулы, следует ожидать влияния ε на константу равновесия этого процесса.
В литературе имеются весьма скудные данные по влиянию растворителя на константу равновесия процессов образования продуктов присоединения ![]() . Исследования в этом направлении охватывают ограниченный круг растворителей в небольшом интервале диэлектрических проницаемостей; кроме того, не всегда удается разграничить влияние физических и химических факторов.
. Исследования в этом направлении охватывают ограниченный круг растворителей в небольшом интервале диэлектрических проницаемостей; кроме того, не всегда удается разграничить влияние физических и химических факторов.
2. Влияние растворителя на константы устойчивости комплексных соединений
Рассмотрим вопросы, связанные с изменением константы равновесия (константы устойчивости) Кк процессов комплексообразования, т. е. процессов присоединения к иону металла иона (в частном случае нейтральной молекулы) лиганда
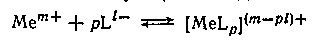
при переходе от одного растворителя к другому, либо с изменением состава смешанного растворителя.
