Растворение твердых веществ
Из изложенного выше следует, что определение порядка реакции много сложнее чем определение энергии активации, так как требует численного или графического дифференцирования полученной из опытов зависимости ![]() . Причина этого усложнения ясна: концентрация активного реагента в периодическом опыте, как правило, может изменяться в больших интервалах. В тоже время температуру в ходе опыта можно легко поддерживать постоянной, в пределах
. Причина этого усложнения ясна: концентрация активного реагента в периодическом опыте, как правило, может изменяться в больших интервалах. В тоже время температуру в ходе опыта можно легко поддерживать постоянной, в пределах ![]() . Определение порядка реакции можно упростить, если концентрацию активного реагента в ходе периодического опыта не изменять. Это достигается путем восполнения убыли реагента в ходе растворения (периодическое дозирование), или сделать это изменение пренебрежимо малым, проводя опыт с очень большим избытком активного реагента. Этого можно достичь предварительным расчетом, чтобы даже при полном растворении твердого растворяющегося вещества, концентрация растворителя не снизилась более, чем на 5-10% от исходной. Во всех выше описанных случаях правая часть уравнения (16) или (16а) должна являться постоянной величиной, поэтому
. Определение порядка реакции можно упростить, если концентрацию активного реагента в ходе периодического опыта не изменять. Это достигается путем восполнения убыли реагента в ходе растворения (периодическое дозирование), или сделать это изменение пренебрежимо малым, проводя опыт с очень большим избытком активного реагента. Этого можно достичь предварительным расчетом, чтобы даже при полном растворении твердого растворяющегося вещества, концентрация растворителя не снизилась более, чем на 5-10% от исходной. Во всех выше описанных случаях правая часть уравнения (16) или (16а) должна являться постоянной величиной, поэтому 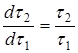 , и зависимость
, и зависимость ![]() является линейной.
является линейной.
Поэтому необходимость в дифференцировании отпадает, и расчетная формула для ![]() принимает вид:
принимает вид:
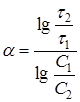 (17)
(17)
причем ![]() и
и ![]() - теперь уже постоянные величины.
- теперь уже постоянные величины.
2.3 Определение кинетической функции
Для описания растворения необходима кинетическая характеристика процесса растворения. Выразим время в безразмерных единицах – в долях времени полного растворения ![]() . Безразмерное время, равное отношению продолжительности растворения
. Безразмерное время, равное отношению продолжительности растворения ![]() к времени полного растворения
к времени полного растворения ![]() , обозначим через х:
, обозначим через х:
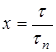 .
.
В качестве кинетической характеристики процесса удобно использовать зависимость доли нерастворившегося компонента ![]() от безразмерного времени х при постоянных концентрациях и температуре. Зависимость
от безразмерного времени х при постоянных концентрациях и температуре. Зависимость ![]() называется кинетической функцией.
называется кинетической функцией.
Результаты периодического опыта дают зависимость доли нерастворившегося продукта ![]() от времени
от времени ![]() , для получения кинетической функции
, для получения кинетической функции ![]() достаточно выразить время в безразмерных единицах
достаточно выразить время в безразмерных единицах 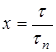 , причем время полного растворения
, причем время полного растворения ![]() определяют в том же опыте.
определяют в том же опыте.
Подобный способ с известным приближением можно применять в тех случаях, когда изменения концентрации активного реагента в ходе растворения малы (например при большом избытке активного реагента).
Для определения кинетической функции могут быть использованы результаты любого периодического опыта, проведенного при постоянных значениях концентрации активного реагента и температуры. Методика определения сводиться к следующему.
1. Результаты периодического опыта представляют в виде зависимостей доли нерастворившегося компонента ![]() и концентрации активного реагента
и концентрации активного реагента ![]() от времени
от времени ![]() :
: ![]() и
и ![]() .
.
Эти зависимости можно представить в виде графиков, таблиц или уравнений, в соответствии с выбранным способом вычисления интегралов. Безразмерное время х, соответствующее любому значению ![]() рассчитывают, пользуясь уравнением:
рассчитывают, пользуясь уравнением:
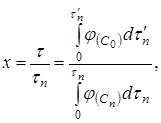 (18)
(18)
где ![]() - время, необходимое для достижения любого значения
- время, необходимое для достижения любого значения ![]() в условиях периодического опыта, т.е. при переменной концентрации активного реагента
в условиях периодического опыта, т.е. при переменной концентрации активного реагента ![]() .
.
Верхние пределы интегрирования ![]() и
и ![]() выражают соответственно время, необходимое для достижения определенного значения
выражают соответственно время, необходимое для достижения определенного значения ![]() и время полного растворения в периодическом опыте с изменяющейся концентрацией реагента (в отличие от
и время полного растворения в периодическом опыте с изменяющейся концентрацией реагента (в отличие от ![]() и
и ![]() , выражающих те же понятия, но при постоянной концентрации С.
, выражающих те же понятия, но при постоянной концентрации С.
2. По уравнению (18) вычисляют значение х, отвечающее определенному значению ![]() .
.
При этом верхний предел интеграла, стоящий в числителе, означает время необходимое для достижения этого значения ![]() в периодическом опыте. Такие вычисления проводят для ряда последовательных значений доли нерастворившегося компонента
в периодическом опыте. Такие вычисления проводят для ряда последовательных значений доли нерастворившегося компонента ![]() . Результаты расчетов, представленные в виде графика, таблицы или апроксимированные аналитическим выражением, дают кинетическую функцию
. Результаты расчетов, представленные в виде графика, таблицы или апроксимированные аналитическим выражением, дают кинетическую функцию ![]()
Графический вариант описанного метода иллюстрируется рис.1
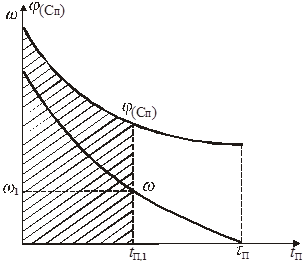
Рис.1. К графическому определению кинетической функции
Значение х соответствующее некоторому ![]() , равно отношению заштрихованной площади ко всей площади под кривой
, равно отношению заштрихованной площади ко всей площади под кривой ![]() . С помощью такого графика можно легко определить значение х для ряда значений
. С помощью такого графика можно легко определить значение х для ряда значений ![]() и составить таблицу или построить график зависимости
и составить таблицу или построить график зависимости ![]() .
.
Из уравнения (18) видно, что для определения х нужно знать зависимость скорости процесса от концентрации, т.е. функцию ![]() .
.
