Реакции окисления в промышленном органическом и нефтехимическом синтезе
Окисление органических соединений занимает важное место в промышленном органическом и нефтехимическом синтезе. Окисляют парафиновые углеводороды, нафтены, арены, олефины, диены, спирты, альдегиды, алкины, меркаптаны, амины и др. органические соединения. В качестве окислителей используют O2, H2O2, ROOH, O3, N2O, неорганические окислители, включая Cl2, Br2, Cl2O и др.
Процессы окисления по разным признакам можно классифицировать следующим образом:
парциальное окисление;
глубокое окисление (обычно до СО2 и Н2О);
гомогенное газофазное окисление – обычно радикально-цепное автоокисление или инициированное окисление, процессы горения;
гомогенное гетерофазное (жидкофазное) окисление;
гетерогенно-каталитическое окисление.
Гомогенное жидкофазное окисление делится на радикально-цепное автоокисление (или инициированное окисление) и каталитическое окисление.
Приведем типичные реакции каталитического жидкофазного и гетерогенного окисления органических соединений.
Типичные окислители и реакции
Окисление кислородом
а) Радикально-цепное жидкофазное окисление алкилароматических соединений (катализ комплексами металлов)
![]()
![]()
б) "Мерокс"-процесс
![]()
в) "Вакер"-процесс (окисление олефинов)
![]()
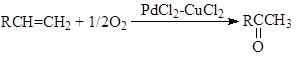
г) Реакция Моисеева (синтез винилацетата)
![]()
д) окислительное карбонилирование метанола
![]()
е) окислительная димеризация
Реакция Глязера-Залькинда:
![]()
Реакция Моритани-Фудживары:
![]()
ж) окислительное хлорирование
![]()
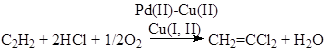
Окисление пероксидом водорода и гидропероксидами
а) Реакция Прилежаева
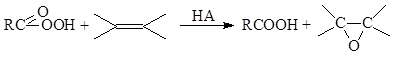
б) Эпоксидирование олефинов
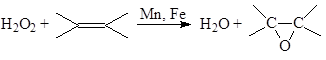
в) Окисление аренов и фенолов
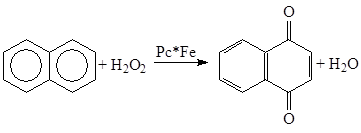
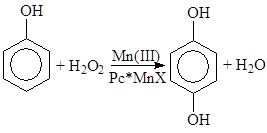
Pc* – замещенные фталоцианины
г) "Халкон"-процесс

Окисление О2 в гетерогенном катализе
а) окисление спиртов
![]()
![]()
б) окисление ароматических соединений
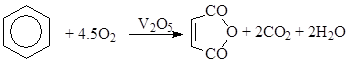
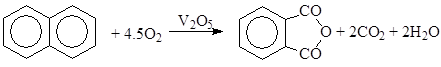
в) окисление алканов (окислительное дегидрирование)
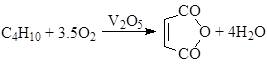
г) окисление олефинов
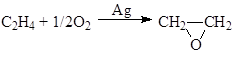
![]()
д) окислительный аммонолиз парафинов и олефинов
![]()
![]()
е) реакция Моисеева в паровой фазе
![]()
ж) синтез аллилацетата
![]()
з) окислительная димеризация метана
![]()
и) окислительное хлорирование этилена
![]()
Появились и новые окислители, например, закись азота N2O. Бензол окисляется этим окислителем на цеолитах ZSM-5, содержащих железо, при 350 – 400оС. Селективность ~100%, конверсия 8 – 13%.
![]()
Недавно (в 2002 г) установлено (Г.И.Панов), что N2O в жидкой фазе без катализатора при давлении 10 атм и температурах 140 – 250оС окисляет олефины до кетонов с селективностью > 98%.
Некоторые процессы, механизмы и кинетические модели
"Вакер"-процесс. Реакция окисления олефинов до карбонильных соединений была открыта практически одновременно в Германии (группа доктора Юргена Смидта в фирме "Consortium für Electrochemie") и И.И.Моисеевым, М.Н.Варгафтиком и Я.К.Сыркиным в СССР (МИТХТ им. М.В.Ломоносова) в 1957 – 1959 гг. Реакция протекает в воде или водно-органических растворах комплексов Pd(II) и Cu(II) при атмосферном давлении и температурах 70 – 95оС, например, синтез ацетальдегида:
![]() (1)
(1)
Реакция (1) вызвала интерес у промышленных фирм, и уже в 1962 году фирма "Wacker Chemie" построила производство альдегида по этой реакции. В промышленных условиях используют давление 10 – 13 атм и температуру 110 – 120оС. Процесс (1) складывается из трех макростадий (2 – 4):
![]() (2)
(2)
![]() (3)
(3)
![]() (4)
(4)
Таким образом, PdCl2 катализирует окисление этилена окислителем CuCl2 (стадии (2) и (3)), а CuCl2 катализирует окисление Pd0 кислородом (стадии 3, 4). Система PdCl2-CuCl2 является полифункциональным катализатором брутто-процесса (1). Интересно, что молекула воды также катализирует брутто-реакцию и является непременным участником процесса в этой каталитической системе. Поскольку скорость окисления Cu(I) кислородом достаточно велика, стационарность процесса обеспечивается равенством скоростей реакций (2) и (3). В условиях промышленного процесса скорость реакции (3) обеспечивает отсутствие Pd0 в форме металлической фазы, и скорость реакции (1) в определенных пределах не зависит от [CuCl2]. Вместо CuCl2 можно использовать другие промежуточные окислители, например, п-бензохинон, концентрация которого при определенном избытке также не влияет на скорость образования ацетальдегида. Эту систему и использовали для построения кинетической модели и изучения механизма реакции. Очевидно, таким образом, что главные события, приводящие к очень интересному превращению этилена с участием H2O, происходят в реакции (2).
Кинетическое уравнение для реакции (2) в присутствии п-бензохинона (Q) было получено в закрытой системе без газовой фазы (И.И.Моисеев и др.) и по поглощению этилена в двухфазном реакторе полного смешения волюмометрическим методом (П.Генри). В области концентраций PdCl2 до 0.02 М при постоянной ионной силе (I = 1 – 3) в системе NaCl – LiClO4 – HCl – HClO4 = Const Pd(II) находится преимущественно в форме PdCl42– , и закомплексованность Pd(II) этиленом не существенна. Скорость реакции (2) или реакции (5)
