Реакции С и О ацилирования
Введение.
Реакции ацилирования обладают очень многими полезными свойствами. Они позволяют вести в молекулу функциональную группу C=O путем реакций присоединения либо замещения, не подвергая исходную молекулу окислению (восстановлению). Таким образом, можно получать соединения различных классов: а) амиды; б) сложные эфиры; в) ангидриды карбоновых кислот; г) кетоны и другие полезные соединения. Неудивительно, что реакции ацилирования находят широкое применение в промышленности и в химических исследованиях. В своем докладе я рассмотрю три наиболее важных типа реакций ацилирования C-ацилирование, O-ацилирование и N-ацилирование.
Реакции C-ацилирования.
Наиболее часто в реакциях С-ацилирования используются металлоорганические соединения (реактивы Гриньяра, кислоты Льюиса, соединения алкила с металлом, алкоголяты металлов, а также комплексные соли с алкильными лигандами).
Реакция алкил-де-галогенирования.
Рассмотрим реакцию алкил-де-галогенирования (превращения ацилгалогенидов в кетоны с помощью металлоорганических соединений). Ацилгалогениды гладко и в мягких условиях взаимодействуют с диалкилкупратами лития, давая с высокими выходами кетоны. Это происходит по следующей схеме:
Другой тип металлоорганических реагентов, которые дают хорошие выходы кетонов при обработке ацилгалогенидами, - это кадмийорганические соединения R2Cd (получаемые из реактивов Гриньяра) В этом случае группа R может быть арильной или первичной алкильной. Вторичные и третичные алкилкадмиевые реагенты оказываются, как правило, недостаточно устойчивыми, чтобы служить полезными реагентами в этой реакции. Как в R’COX, так и в R2Cd может присутствовать сложноэфирная группа. Цинкорганические соединения ведут себя аналогично, но используются реже. Ртутьорганические соединения и тетраалкилсиланы также вступают в эту реакцию при катализе AlX3.
Реакция алкил-де-ацилокси-замещения.
Как и ацилгалогениды, ангидриды и сложные эфиры карбоновых кислот при обработке реактивами Гриньяра дают третичные спирты. Для увеличения выхода кетона применяют низкие температуры и обратный порядок смешения реагентов.
Реакции сочетания ацилгалогенидов.
Известны также интересные реакции сочетания ацилгалогенидов, в результате которых можно получать симметричные a-дикетоны.
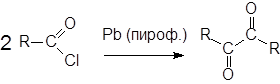 |
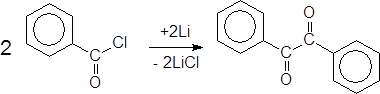 |
Реакции ацилирования кетонов ангидридами.
Ацилирование кетонов ангидридами в присутствии трифторида бора в качестве катализатора приводит к b-дикетонам. В случае несимметричных кетонов ацилирование идет главным образом по наиболее замещенному положению:
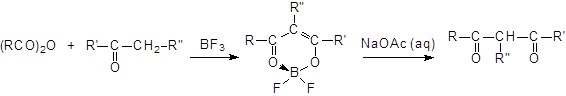
Продуктом является комплекс, содержащий BF2, который под действием водного ацетата натрия разлагается с образованием ацилированного кетона. Следовательно, трифторид бора и кетон надо брать в эквимолярных соотношениях.
Реакции ацилирования сложных эфиров сложными эфирами. Конденсации Кляйзена и Дикмана.
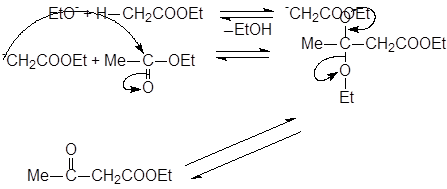 |
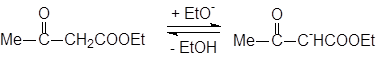 |
Когда в реакцию вводят смесь двух различных сложных эфиров, каждый из которых содержит a-атом водорода, то обычно получается смесь всех четырех возможных продуктов; вследствие этого реакция редко используется в синтетических целях. Однако, если атом водорода в a-положении имеется только в одном из сложных эфиров, смешанная реакция часто дает удовлетворительные результаты.
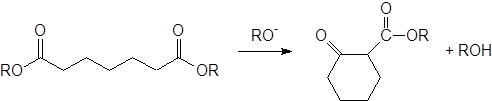 |
Наилучшие результаты при конденсации Дикмана получены для синтеза пяти-, шести- и семичленных циклов. Реакции, приводящие к циклам с числом атомов в кольце от 9 до 12, идут с очень низким выходом или не идут совсем; циклы большего размера синтезированы с использованием метода высокого разбавления.
Реакция ацилирования Фриделя-Крафтса.
Данная реакция позволяет присоединять к бензолу ацильный радикал. В присутствии кислот Льюиса хлорангидриды и ангидриды кислот дают ион ацилия R–C+=O, который действует как эффективный электрофильный реагент, приводя к образованию кетона:
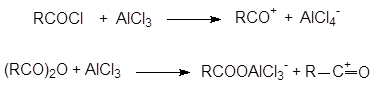 |
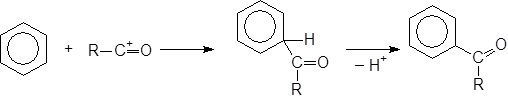 |
