Реакция альдольно-кротоновой конденсации, и ее оптимизация
Используя принцип альдольно-кротоновой конденсации, можно вводить в реакцию с альдегидам целый ряд соединений, обладающих С-Н-кислотностью. При этом не всегда можно провести четкую границу между этой реакцией и реакцией Кневенагеля.
При синтезе Перкина альдегиды взаимодействуют с ангидридами алифатических карбоновых кислот, причем образуются a,b-ненасыщенные карбоновые кислоты. В качестве оснований, служащих конденсирующими средствами, используют щелочные соли карбоновых кислот или третичные основания (пиридин). Лучше всего идет реакция с ароматическими альдегидами, она приводит к образованию коричных кислот:
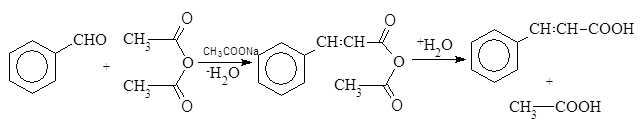
Конденсация формальдегида с уксусной кислотой с образованием акриловой кислоты также имеет значение в промышленности.
В жестких условиях в качестве метиленового компонента можно использовать также сложные эфиры карбоновых кислот. Они реагируют с ароматическими альдегидами и кетонами с образованием коричных кислот в присутствии алкоголятов щелочных металлов в качестве катализаторов. (По отношению к алифатическим кетонам сложные эфиры ведут себя как карбонильные компоненты).
Ацетонитрил может конденсироваться с кетонами и ароматическими альдегидами в условиях межфазного катализа в присутствии концентрированного раствора гидроксида калия.
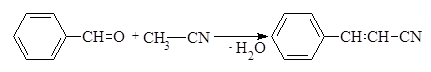
Более кислые сложные эфиры a-хлорозамещенныех жирных кислот реагируют в роли метиленового компонента, как с альдегидами, так и с кетонами. При этом сначала образуется хлорогидрин, который в условиях реакции немедленно отщепляет хлороводород (реакция Дарзана-Кляйзена):
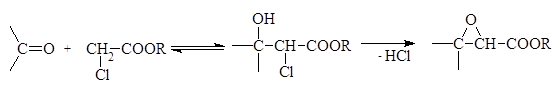 (реакция I)
(реакция I)
Полученные таким способом 2,3-эпоксиэфиры (глицидные эфиры) при омылении декарбоксилируются и перегруппировываются в альдегиды:
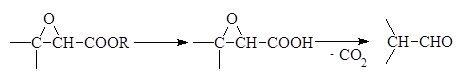
В условиях межфазного катализа из хлороацетонитрила аналогично реакции I в присутствии гидроксида натрия можно получить 2,3-эпоксипропионитрилы.
В качестве других С-Н-кислотных соединений, реагирующих с альдегидами как метиленовые компоненты, можно назвать, например, a- и g-пиколины, а также циклопентадиен.
Иллюстрацией такого рода синтезов может служить получение кониина ‑ первого алкалоида, синтезированного Ладенбургом в 1886 г.
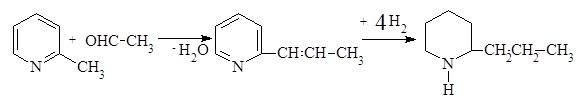
Из 2-метилпиридина и формальдегида через промежуточный 2-гидроксиэтилпиридин в промышленности получают мономер 2-винилпиридин.
При синтезе алкилпиридинов в промышленности промежуточными стадиями также являются реакции альдольно-кротоновой конденсации, связанные с образованием иминов и дегидрированием. Так, из ацетальальдегида и аммиака над Al2O3 при 450оС образуется смесь a- и g-пиколина, конденсация чрезвычайно многогранна, в тех же условиях в присутствии формальдегида получают пиридин и b-пиколин, причем последний можно окислить далее до никотиновой кислоты.
Как показывают эти примеры, адольно-кротоновая и имеет важное препаративное значение для создания связей С-С.
Общие методики проведения Альдольно-кротоновой конденсации:
А. Конденсация алифатических альдегидов.
В трехгорлую колбу емкостью 250 мл, снабженную мешалкой, капельной воронкой и внутренним термометром, помещают 1 моль соответствующего альдегида (используют только свежеперегнанные альдегиды и кетоны) в 75 мл эфира. При охлаждении водой очень медленно прибавляют 15%-ный раствор 0.02 моля КОН в метаноле, причем температура в колбе должна поддерживаться в пределах 10-15оС. Затем перемешивают еще 1,5 ч при комнатной температуре, нейтрализуют эквимолярным количеством ледяной уксусной кислоты, отделяют осадок ацетата калия, сушат сульфатом натрия и перегоняют при возможно более низкой температуре.
Б. Конденсация алифатических альдегидов (кроме формальдегида) с кетонами.
В трегорлую колбу емкостью 500 мл, снабженную мешалкой, капельной воронкой, внутренним термометром, помещают кетон (свежеперегнанный) и прибавляют 0.03 моля КОН в виде 15%-ного метанольного раствора. Если кетон имеет только одну реакционноспособную группу (метильную или метиленовую), то берут 1 моль, во всех других случаях ‑ 3 моля, если хотят получить моноаддукт.
При интенсивном перемешивании и охлаждении водой прибавляют из капельной воронки (очень медленно, в течение 4-6 ч) 1 моль свежеперегнанного алифатического альдегида в 75 мл эфира (при температуре внутри колбы 10-15оС), а затем перемешивают еще 1.5 ч при комнатной температуре. После этого нейтрализуют ледяной уксусной кислотой, сушат сульфатом натрия и перегоняют.
В. Реакции ароматических альдегидов с кетонами.
В трегорлую колбу емкостью 1 л, снабженную мешалкой, капельной воронкой и внутренним термометром, помещают раствор 1 моля свежеперегнанных альдегида и кетона в 200 мл метилового спирта. Если берут кетоны с более чем с одной реакционноспособной метильной или метиленовой группой и хотят получить продукты моноконденсации, то молярное соотношение кетона к альдегиду должно составить 3:1; если хотят получить продукт конденсации двух молекул альдегида с 1 молекулой кетона, то это соотношение должно быть 0.5:1. К раствору при хорошем перемешивании прибавляют из капельной воронки 0.05 моля гидроксида калия в виде 15%-ного раствора в метаноле при температуре в колбе 20-25оС. Реакционную смесь перемешивают еще 3 ч, нейтрализуют ледяной уксусной кислотой, образовавшиеся твердые продукты реакции отфильтровывают и промывают водой. В других случаях реакционную смесь разбавляют водой и фильтруют или извлекают эфиром. Эфирные вытяжки промывают водой, сушат сульфатом натрия и перегоняют.
При получении нитростиролов следует брать 1 моль щелочи, вести реакцию в течение 0.5 ч и после этого вылить реакционную смесь в двойное молярное количество 20%-ной соляной кислоты.
II Постановка задачи.
В рамках фундаментального исследований, проводящихся в ИОХ РАН, необходимо было осуществить синтез ряда продуктов альдольно-кротоновой конденсации: ароматических альдегидов (в качестве карбонильных компонентов) с метилалкил- и метиларилкетонами (в качестве метиленовых компонентов).
В нашу задачу также входила оптимизация методики синтеза соединений данного типа. В качестве основного приема оптимизации мы запланировали проведение реакции конденсации в насыщенном водно-спиртовом растворе исходных веществ с добавлением водного раствора щелочи. (Согласно основной литературной методике реакцию проводят в спиртовом растворе [1]) Поскольку продукты конденсации, как правило, существенно хуже растворимы, чем исходные вещества мы рассчитываем, что целевые продукты будут выделяться в виде осадка; т.е. уходить из сферы реакции, что ,по-нашему мнению, может ослабить процессы более глубокой конденсации и привести к упрощению методики выделения продуктов реакции.
