Ртутно-цинковые элементы
Содержание.
Введение
Ртутно-цинковые аккумуляторы
Теория
Устройство дискового элемента
Характеристики
Перезаряжаемые элементы
Технические характеристики
Первичные химические источники тока, разработанные для изделий спецтехники
ХИТ производственного назначения ртутно-цинковой системы (Hg-Zn)
Ртутно-цинковые элементы и батареи
Список используемой литературы
Введение.
Ртутно-цинковые элементы питания используются для автономного питания в контрольно-измерительных приборах, дозиметрической аппаратуре, регистрирующих измерителях напряжения, слуховых аппаратах, часах, системах противопожарной сигнализации, геофизических устройствах.
Особенности:
- стабильное напряжение;
- миниатюрность;
- высокие разрядные токи;
Источникам данной системы не требуется время для "отдыха", элементы прекрасно работают и в прерывистом и в непрерывистом режиме. Кроме того, элементы обладают устойчивостью к коррозии и к высокой относительной влажности в процессе длительного срока хранения.
Электрохимическая система: цинк-окись ртути-гидрат окиси натрия. Имеют высокие энергетические показатели, характеризуются практически плоской кривой разряда, но работоспособны только при положительных температурах (0 .50°C). При малых токах разряда и стабильной температуре напряжение на элементе остается почти неизменным. Практически не имеют газовыделения. Из-за наличия ртути экологически вредны и к применению не рекомендуются. Из-за "ползучести" электролита могут иметь небольшой беловатый налёт соли (карбоната) на уплотнительном кольце. Основные области использования: фотоэкспонометры, фотоаппараты, измерительные приборы, слуховые аппараты, электронные наручные часы (как правило, устаревшие модели). Срок хранения до начала эксплуатации не более 1 .1,5 лет.
Ртутно-цинковые аккумуляторы.
Среди щелочных первичных элементов с цинковым анодом ртутно-цинковые элементы (РЦЭ) в некотором роде противоположны медно-цинковым. Они выпускаются в виде герметичных элементов малой емкости - от 0,05 до 15 А·ч. В них используется ограниченный объем электролита [около 1 мл/(А·ч)], находящегося в пористой матрице; вследствие этого цинковый электрод работает только на вторичном процессе.
Современные РЦЭ были разработаны С. Рубеном в США в начале 40-х годов нашего века. Благодаря высокой эффективности предложенной им конструкции «пуговичных» (дисковых) элементов широкое производство таких элементов было налажено в США еще в годы второй мировой войны, а в, других странах—после войны.
Теория.
Основу РЦЭ составляет электрохимическая система Zn|KOH|HgO. Конечным продуктов разряда является оксид цинка. Разряд оксида ртути описывается реакцией
HgO+Н20+2е-®Hg+2ОН-.
В начале разряда на потенциальной кривой Е+-τ наблюдается кратковременный спад потенциала, что вызвано кристаллизационной поляризацией при образовании первых микро капель ртути. В дальнейшем катодный потенциал сохраняет стабильность почти до конца разряда, поскольку поляризация мала, а омические потери напряжения в активной массе по мере перехода оксида ртути в металлическую ртуть снижаются.
Сохранность заряда элемента определяется саморазрядом цинкового электрода, причем лимитирующей является катодная реакция восстановления воды до водорода.
Элемент должен сохранять герметичность в течение нескольких лет, поэтому скорость саморазряда должна быть настолько малой, чтобы не создавалось избыточное давление, способное разгерметизировать элемент. Для снижения скорости саморазряда цинкового анода принимают следующие меры: используют особо чистый цинк; с целью резкого повышения водородного перенапряжения цинк обильно амальгамируют; подавляют выделение водорода на поверхности других металлов, контактирующих с цинковым анодом; в качестве электролита используют раствор КОН высокой концентрации, который предварительно насыщают цинкатом калия; структуру активной массы отрицательного электрода создают достаточно грубодисперсной, для этого применяют цинковые опилки или цинковый порошок крупных фракций.
Устройство дискового элемента.
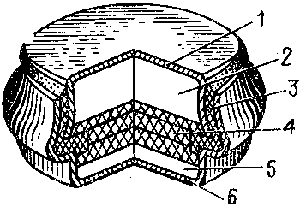
Рис.1. Устройство ртутно-цинкового элемента: 1 - крышка (отрицательный полюс); 2 - цинковый электрод; 3 - резиновое уплотнительное кольцо; 4 - бумага, пропитанная электролитом; 5 - ртутний электрод; 6 - корпус (положительный полюс).
Положительный электрод представляет собой активную массу 5, впрессованную в стальной корпус 6. Активная масса состоит из тонкокристаллического красного оксида ртути, в который добавлены графит и дубитель БНФ. Малозольный мелкомолотый графит повышенной чистоты служит токопроводящей добавкой. Диспергатор дубитель БНФ как органическое поверхностно-активное вещество адсорбируется на ртути, препятствуя образованию крупных капель металла. В результате диспергированная ртуть равномерно распределяется в объеме электрода, повышая его электрическую проводимость и обеспечивая высокий коэффициент использования. Кроме того, крупные капли ртути, попав в межэлектродное пространство, способны вызвать короткое замыкание и вывести элемент из строя.
Корпус, в который впрессована активная оксидно-ртутная масса, служит одновременно каркасом электрода и положительным токоотводом. Он отштампован из стальной ленты толщиной 0.3—0.4 мм и защищен от коррозии электролитическим никелем.
Отрицательным электродом является стальная крышка 1, в которую запрессована активная масса 2—цинковые опилки, благодаря чему электрод обладает необходимой прочностью. Для борьбы с саморазрядом цинк амальгамируют, содержание ртути в активной массе достигает 10%. Как и корпус, крышка кроме своего прямого назначения выполняет функции каркаса электрода и токоотвода. Важную роль играет компактное и достаточно толстое (около 20 мкм) оловянное покрытие, которое служит для защиты стальной поверхности крышки от коррозии, и препятствует саморазряду цинка, поскольку перенапряжение выделения водорода на железе гораздо ниже, чем на амальгамированном олове.
Не смотря на то, что оксид ртути значительно дороже чем цинка, оксиднортутная активная масса берется в избытке, и по этому емкость элемента лимитируется цинковым электродом. Если бы емкость ограничивалось положительным электродом, то вслед за зарядом HgO на никелированной поверхности корпуса начался бы процесс разрядки молекул воды с образованием водорода. Вероятность разрушения элемента и вытекания ртути при этом весьма велика.
В РЦ элементах в качестве электролита используют раствор КОН высокой степени чистоты, в который предварительно вводят оксид цинка для образования цинката калия. Иногда в раствор добавляют диоксид кремния, что замедляет старение электролита, препятствует преждевременному распадению тетрагидроксоцинката. Электролит пропитывает электродные активные массы и сепаратор-диафрагму. Диафрагма 9 состоит из 2-4 слоев щелочестойкой хлопковой бумаги, обладающей высокой пористостью и гидрофильностью, впитывающей до восьмикратного объема электролита, плотно заполняя все межэлектродное пространство.
